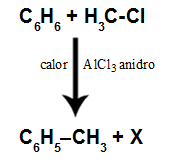
La polaridad de las moléculas es un aspecto muy importante, ya que las características de las sustancias están determinadas, entre otros factores, por el hecho de que sus moléculas sean polares o apolares.
La determinación de la polaridad de una molécula se puede realizar utilizando el Momento bipolar o Momento dipolo resultante, cuyo símbolo es 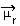 . Si solo estamos hablando del momento dipolar de cada enlace en la molécula, entonces el símbolo es la letra griega mi (µ).
. Si solo estamos hablando del momento dipolar de cada enlace en la molécula, entonces el símbolo es la letra griega mi (µ).

La molécula será no polar si el momento dipolar es igual a cero, pero si no es cero, significa que es polar.

Hay dos cosas importantes a considerar al determinar este momento dipolar resultante. Veamos cuáles son:
1) diferencia de electronegatividad entre los átomos de los elementos que participan en la reacción. Por ejemplo, la molécula de HF tiene una marcada diferencia en electronegatividad, ya que el flúor atrae, mucho más que el hidrógeno, el par de electrones en el enlace. Por tanto, la distribución de cargas no es simétrica, con dipolos eléctricos.
Este dipolo está representado por un vector que mira hacia el extremo que concentra la mayor cantidad de electrones, es decir, del átomo más electronegativo al más pequeño. Entonces, en este caso, el vector, que es el único, será el vector resultante, como se indica a continuación:
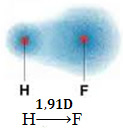
Tenga en cuenta que el valor del vector es el mismo que el momento dipolar, que se da en la unidad debye (D = 3.33. 10-30 culombio. subterraneo). Dado que el momento dipolar no es cero, la molécula y el enlace son polar.
No pares ahora... Hay más después de la publicidad;)
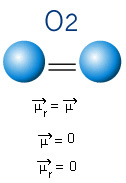
En la siguiente molécula también tenemos una molécula con solo dos átomos, sin embargo, en este caso, corresponde a una sustancia simple, es decir, está formada por un solo tipo de elemento. Por tanto, no hay diferencia de electronegatividad; los átomos también atraen electrones, que están distribuidos simétricamente. El momento dipolar resultante es igual a cero, por lo que tanto el enlace como la molécula son apolar.
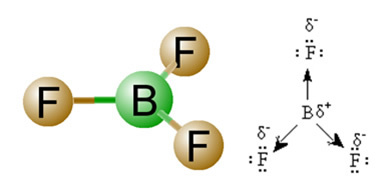
2) Geometría de la molécula, es decir, la disposición espacial de los vectores. La molécula de BF3 tiene tres enlaces polares, en los que el flúor es el más electronegativo, por lo que los vectores se dirigen hacia él. Sin embargo, dado que la disposición espacial de los átomos es trigonal plana, esto hace que los electrones tengan una distribución simétrica alrededor del átomo central. Por lo tanto, el resultado es que estos tres vectores se cancelan entre sí y el momento dipolar es igual a cero. Por tanto, la molécula de BF3 é apolar.
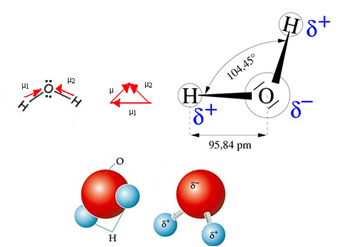
La molécula de agua tiene dos vectores, sin embargo, su geometría espacial no es plana, sino en forma de V. Nótese en la siguiente figura que de esta manera sus vectores no se anulan entre sí, los electrones se distribuyen asimétricamente y más concentrados en el átomo más electronegativo, que es el oxígeno. Por lo tanto, el momento dipolar es diferente de cero y la molécula de agua es polar:
Por Jennifer Fogaça
Licenciada en Química