Dado que existen miles de compuestos orgánicos, el fenómeno de la isomería puede adoptar varias formas. Por tanto, la isomería se puede clasificar básicamente en dos tipos: isomería plana o constitucional y isomería espacial o estereoisomería. Cada tipo mencionado se puede subdividir, como se muestra en el siguiente diagrama:
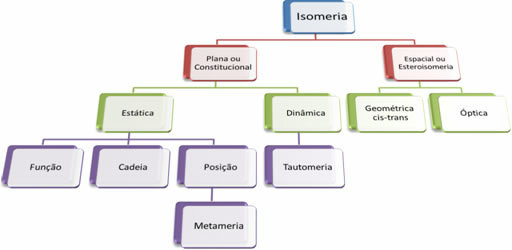
Ver cada caso:
1. Isomería plana o constitucional: Los isómeros de este tipo tienen la misma fórmula molecular y se distinguen por fórmulas estructurales planas. Hay cinco casos de isomería plana: función, cadena, posición, metamerismo y tautomería.
1.1.Isomería funcional o funcional: La diferencia entre los isómeros está en el grupo funcional.
Ejemplo: fórmula molecular C3H6O
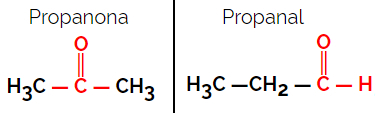
Tenga en cuenta que la propanona es del grupo cetona y el propanal es del grupo aldehído.
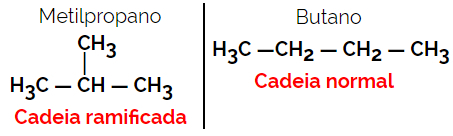
1.2. Isómeros de cadena o esqueléticos: La diferencia entre los isómeros está en el tipo de cadena. Por ejemplo, un isómero es de cadena abierta y el otro de cadena cerrada, o uno es de cadena normal y el otro de cadena ramificada, o uno es una cadena homogénea y el otro es una cadena heterogénea.
Ejemplo: fórmula molecular C4H10
1.3.Isomería posicional o posicional: La diferencia está en la posición de una insaturación, un grupo funcional, un heteroátomo o un sustituyente.
Ejemplo: fórmula molecular C4H6

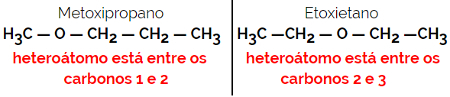
1.4.Isomería de compensación o metamery: Es un tipo especial de isomería de posición, donde la diferencia es la posición del heteroátomo.
Ejemplo: fórmula molecular C4H10O
1.5.Isomery dinámico o Tautomery: Es un tipo especial de isomería de función, en el que los isómeros coexisten en equilibrio dinámico en solución. Los dos tipos principales de tautomeria se encuentran entre una cetona y un enol (equilibrio de cetoenol) y entre un aldehído y un enol (equilibrio de aldoenol).
Ejemplo: fórmula molecular C3H6O
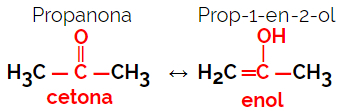
2. Isomería espacial o esteroisomería: En este caso, la diferencia entre los isómeros solo se puede visualizar a través de la orientación de sus átomos en el espacio. Hay dos tipos de estereoisomería: isomería geométrica e isomería óptica.
2.1.Isómeros geométricos o cis-trans: La diferencia es que el isómero denominado como cis tiene los mismos ligandos de carbono en un doble enlace o en compuestos cíclicos en el mismo lado del plano. Los ligandos de isómeros trans están en lados opuestos.
Ejemplo: fórmula molecular C2H2Cl2

Estos compuestos se llaman estereoisómeros.
2.2.Isómero óptico: Ocurre cuando los isómeros pueden desviar un haz de luz polarizada. Si dobla el haz de luz polarizada hacia la izquierda, es un isómero levógiro, pero si se dobla hacia la derecha, se denomina isómero derecho.
Ejemplo:
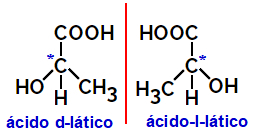
Las moléculas asimétricas como las que se muestran arriba, que son imágenes especulares entre sí y que no se pueden superponer, se denominan enantiómeros.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

