En una transformación isotérmica, el variación de volumen y presión de cierto gas, pero el temperatura constante; de ahí el origen del nombre isotérmico (del griego: Yo asi = igual; termo = calor).
Los científicos Boyle y Mariotte, de forma aislada, realizaron experimentos similares y el resultado obtenido fue: a medida que aumenta la presión, el volumen del gas disminuye.
Piense, por ejemplo, en el émbolo de una jeringa. Si aplicamos presión externa sobre este émbolo, es decir, si aumentamos la presión, el volumen de aire ocupado dentro de la jeringa disminuirá, y viceversa.
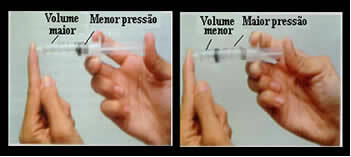
El volumen y la presión son inversamente proporcionales: en el panel izquierdo, la presión es pequeña y el volumen ocupado por el aire es grande. A la derecha, cuando se aplica más presión al émbolo de la jeringa, el volumen disminuye..
Este no es un caso aislado, es algo que se repite con regularidad común para los gases. Por lo tanto, este hecho se expresó en forma de ley, que se puede describir de la siguiente manera:
| Ley de Boyle o Ley de Boyle-Mariotte: A temperatura constante, el volumen ocupado por una masa fija de un gas es inversamente proporcional a su presión. |
Esto significa que si duplicamos la presión de un gas, su volumen se reducirá a la mitad y así sucesivamente. Cuando dos de esas cantidades son inversamente proporcionales, su producto es una constante; así, matemáticamente, esta relación se puede representar de la siguiente manera:
| P.V = k |
Donde k = constante.
Así, si en una primera situación tenemos el valor de presión de cierto gas como P1 y su volumen respectivo como V1, entonces tenemos que:
| PAG1. V1 = k |
Si aumentamos esta presión a P2, su volumen también cambiará a V2 y nuevamente tendremos que:
| PAG2 . V2 = k |
Así llegamos a la conclusión:
| PAG1. V1 = P2. V2 |
Esta constancia se puede ver en el ejemplo que se da en la siguiente tabla, de las presiones y volúmenes de un gas con una masa fija:
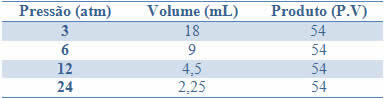
Al graficar estos valores, veremos la formación de una curva.
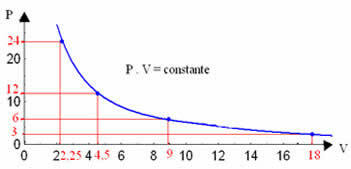
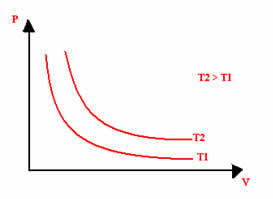
La representación gráfica de una transformación isotérmica siempre será una hipérbola, independientemente de los valores de presión y volumen y temperatura a los que se realizó el experimento. Esta hipérbola se llama isoterma; así, como se puede ver en el gráfico siguiente, diferentes temperaturas dan lugar a diferentes isotermas.
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm
