Tú ésteres son compuestos orgánicos oxigenados que se forman por la reacción química entre un ácido carboxílico es un alcohol. Presente el grupo funcional (compuesto por dos átomos de oxígeno y dos radicales R) representado a continuación:
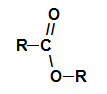
Grupo funcional general de un éster
Estructuralmente, lo que caracteriza al ester es la presencia de algún radical alquilo unido directamente al átomo de oxígeno. En este caso, el radical (R) unido al carbono, que a su vez está doblemente unido al oxígeno, puede ser un radical alquilo o un átomo de hidrógeno.
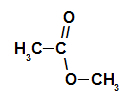
Cadena carbónica de un éster
reacción de esterificación
se trata del reacción química que origina un éster y una molécula de agua a partir de la interacción entre un ácido carboxílico y cualquier alcohol, como en la siguiente ecuación:
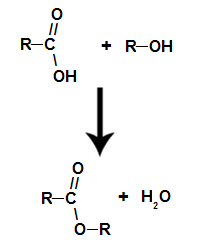
Ecuación química que representa la formación de un éster.
Durante la esterificación, el grupo hidroxilo (OH) del alcohol interactúa con el hidrógeno (H) ionizable del hidroxilo del ácido y forma el molécula de agua.
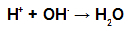
Molécula de agua que forma grupos en la esterificación.
ya el ester se forma uniendo el radical (R) del alcohol con el oxígeno, que queda del hidroxilo del ácido después de la formación de agua.
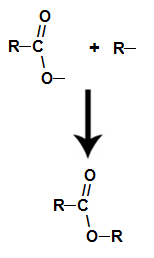
Formación de la molécula de éster
Características de los ésteres
Principales propiedades físicas que presenta ésteres:
Tienen aromas frutales y florales;
ésteres bajos masa molar son líquidos a temperatura ambiente y los que tienen una masa molar elevada son sólidos;
En comparación con los alcoholes y ácidos carboxílicos, los ésteres tienen puntos de fusión y ebullición más bajos;
En comparación con el agua, los ésteres de masa molar inferior son menos densos;
Los ésteres de masa molar inferior son polares y los de masa molar superior son apolares;
En los ésteres polares, predominan las fuerzas dipolo permanente; en los no polares, predominan las fuerzas dipolo inducido;
Los ésteres con menor masa molar son poco solubles en agua y aquellos con mayor masa son insolubles en agua.
Una regla de denominación de éster
Antes de usar la regla de nomenclatura de un ester, es fundamental recordar que este compuesto está formado por la unión de dos partes, una procedente de de ácido carboxílico (en rojo) y el otro de alcohol (en azul), como se representa en la imagen a seguir:
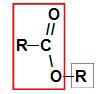
Identificación de las partes que originan el éster
Según la Unión Internacional de Química Pura y Aplicada (IUPAC), la regla oficial para nombrar un éster es:
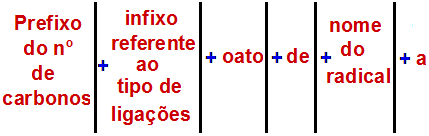
Una regla de denominación de éster
Nota: El prefijo y el infijo siempre corresponden a la parte de ácido carboxílico y el radical corresponde a la parte de alcohol.
Vea a continuación algunos ejemplos de aplicación de la regla de nomenclatura para ésteres:
1er Ejemplo: esencia de frambuesa
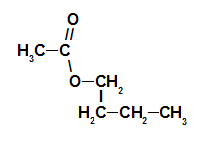
Fórmula estructural de éster de esencia de frambuesa.
Para nombrar este éster, usamos:
No. PrefijoO de carbonos: et, ya que el ácido formador tiene dos carbonos;
Infijo en el tipo de enlaces: un, ya que el ácido formador tiene solo enlaces simples entre carbonos;
el acto;
en;
Radical: butilo, por tener cuatro carbonos en secuencia;
La.
Así, el nombre del éster correspondiente a la esencia de frambuesa es etanoato de butilo.
2do Ejemplo: esencia de piña
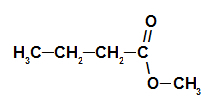
Fórmula estructural del éster de piña
Para formar el nombre de este éster, usamos:
No. PrefijoO de carbonos: pero, ya que la formación de ácido tiene cuatro carbonos;
Infijo en el tipo de enlaces: un, ya que el ácido formador tiene solo enlaces simples entre carbonos;
el acto;
en;
Radical: metilo, ya que el alcohol formador tiene un solo carbono;
La.
Así, el nombre del éster correspondiente a la esencia de piña es butanoato de metilo.
3er Ejemplo: esencia de fresa
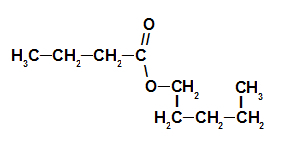
Fórmula estructural de éster de esencia de fresa
Para nombrar este éster, usamos:
No. PrefijoO de carbonos: pero, ya que el ácido formador tiene cuatro carbonos;
Infijo en el tipo de enlaces: un, ya que el ácido formador tiene solo enlaces simples entre carbonos;
el acto;
en;
Radical: pentilo, ya que el alcohol formador tiene cinco carbonos en secuencia;
La.
Así, el nombre del éster correspondiente a la esencia de fresa es butanoato de pentilo.
Usos de ésteres
Los ésteres son bien conocidos por su uso como condimento en alimentos procesados, es decir, sustancias que simulan el sabor y aroma característico de los alimentos naturales, como las frutas. Además, los ésteres todavía se utilizan en la fabricación de medicamentos, cosméticos, perfumes y ceras.
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm