La Teoría de la Hibridación surgió como complemento a la Teoría del octeto, logrando explicar la estructura de un mayor número de moléculas, incluidas moléculas formadas por boro (B).
Este elemento tiene cinco electrones en estado fundamental, con la siguiente configuración electrónica:
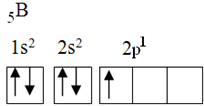
Según la teoría del octeto, el boro solo podría formar un enlace covalente, ya que solo tiene un orbital atómico incompleto. Sin embargo, experimentalmente, se observa que este elemento forma compuestos en los que realiza más de un enlace.
Un ejemplo es el trifluoruro de boro (BF3). Como se muestra a continuación, el boro forma tres enlaces covalentes con el flúor, compartiendo tres pares de electrones y tener seis electrones en su última capa (capa de valencia), es decir, una excepción a la regla de octeto.
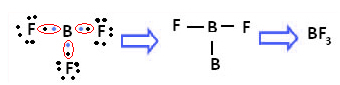
Esto se explica por el fenómeno de hibridación que ocurre con el boro. Resulta que un electrón del subnivel 2s absorbe energía y entra en el estado excitado, en el que salta a un orbital vacío del subnivel 2p. De esta forma, se forman tres orbitales incompletos, que ahora pueden formar tres enlaces covalentes:
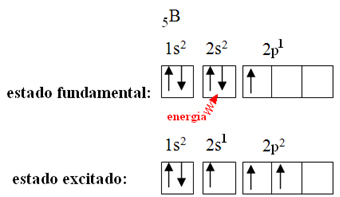
Sin embargo, los enlaces formados en el trifluoruro de boro son todos iguales, pero si miramos arriba, hay dos enlaces diferente, ya que uno de ellos se haría mediante un orbital sy los otros dos mediante un orbital del tipo. tipo p. Aquí es donde tiene lugar la hibridación, es decir, los orbitales incompletos se fusionan, dando lugar a tres orbitales híbridos o hibridado, que son idénticos y diferentes a los originales:
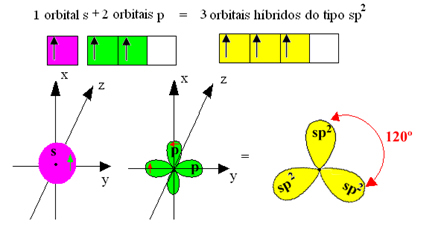
Dado que estos orbitales híbridos constan de un orbital sy dos orbitales p, esta hibridación se llama hibridación sp².
El flúor que se une al boro tiene nueve electrones. Su distribución electrónica y orbitales se muestran a continuación:
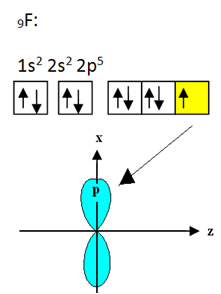
Tenga en cuenta que cada átomo de flúor puede formar solo un enlace covalente y que el orbital que forma este enlace es de tipo p. Entonces, observe a continuación cómo se forman los orbitales al hacer las conexiones que forman el BF3 y ver cómo los enlaces son idénticos, como σp-sp2:
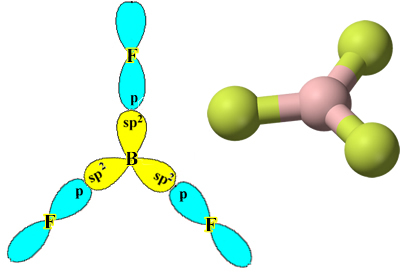
Esto también ocurre con otros elementos, ver, por ejemplo, el texto “Hibridación de berilio”.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
