LAósmosis y el paso de disolvente, de una solución menos concentrada a una solución más concentrada, a través de un membrana semipermeable, hasta que la presión que ejerce la solución sobre la membrana impida el paso del disolvente. Este proceso está destinado a equilibrar la concentración de la solución.
Leer tambien: Soluto y solvente
presión osmótica
LA presión osmótica y el presión ejercida sobre la solución con mayor concentración para que no se produzca la ósmosis, es decir, para que el disolvente no atraviese la membrana semipermeable.
La presión osmótica se utiliza en procesos de desalinización del agua, forzando el proceso de osmosis inversa, haciendo que el solvente pase de la solución más concentrada a la menos concentrada. A este proceso lo llamamos osmosis inversa. Vea la siguiente imagen que compara los dos procesos:
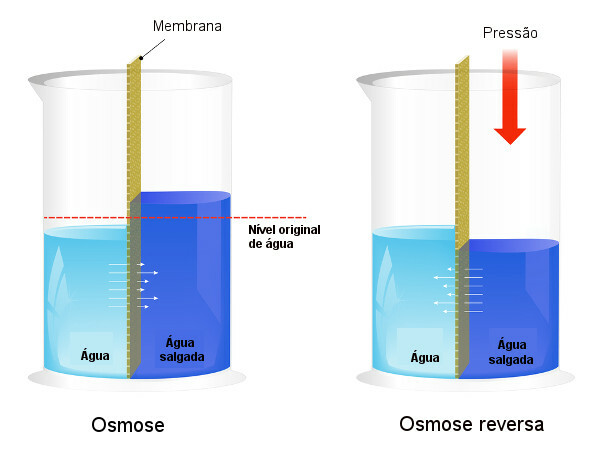
Tenga en cuenta que, en ósmosis, el paso del solvente es en la dirección de la solución más concentrada y que, en ósmosis inversa, el paso es en la dirección opuesta, debido a la presión aplicada. Para obtener más información sobre el tema, lea nuestro texto:
presión osmótica.sepa mas: Ósmosis inversa en la desalación de agua de mar
ecuación de presión osmótica
Presión osmótica, representada por la letra pi (π) de una solución, se puede calcular mediante la siguiente ecuación:
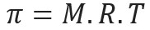
M = concentración en mol / L
R = constante universal de gases perfectos
T = temperatura absoluta, en K
como otros propiedades coligativas, la presión osmótica depende de la concentración de la solución, es decir, cuanto mayor sea la concentración de la solución, mayor será el efecto de la ósmosis sobre las soluciones y, por tanto, mayor será la presión osmótica.
Ejemplos de
La ósmosis aparece en nuestra vida diaria en diferentes momentos. Podemos citar el ejemplo de proceso de salazón de carne para usted conservación. Tú microorganismos que causaría la degradación de la carne perder aguade adentro hacia afuera, que tiene una concentración de sal, lo que hace que los alimentos duren más.
Debido a la sal, también sucede que la las hojas de una ensalada se marchitan por perder agua del interior de su células (algo menos concentrado) para el solución templada en el entorno externo.
La ósmosis también es importante cuando hablamos de sangre humano. Decimos que el Glóbulos rojos y la sangre es una medio isotónico, es decir, tienen la misma presión osmótica, permitiendo la entrada y salida del agua de la celda con facilidad.
Sin embargo, cuando la sangre se vuelve menos concentrada que dentro de los glóbulos rojos (medio hipotónico), el paso del agua se producirá con mayor facilidad dentro de la celda, lo que hincharse hasta reventar. Si la sangre alcanza una concentración mayor que la concentración del glóbulo rojo (medio hipertónico), el las células sanguíneas se marchitan, ya que pierden agua.

Por el mismo principio de conservación de la carne, el conservación de la frutaen las compotas de caramelo, que conservan los alimentos debido a alta concentración de azúcar en la solución.
Los siguientes son otros ejemplos donde ocurre la ósmosis:
- en la subida de la savia en los vasos conductores de la planta;
- a hemodiálisis;
- en el paso selectivo de nutrientes en las células del cuerpo humano.
Para comprender cómo ocurre la ósmosis en la célula animal, la célula vegetal y otros problemas biológicos, lea: Ósmosis: qué es y cómo ocurre en la célula animal y vegetal.
Por Victor Ferreira
Profesor de química


