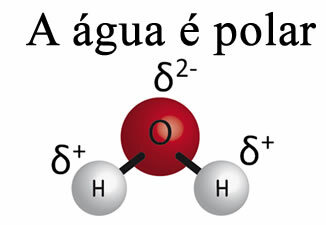
El agua por sí sola no puede eliminar la grasa de los materiales. Esto es porque Lael agua es polar, como se muestra en la imagen de abajo, debido a la diferencia de electronegatividad que existe entre los átomos de hidrógeno y oxígeno de sus moléculas. Por otro lado, la grasa no es polar y por tanto el agua no disuelve las grasas.
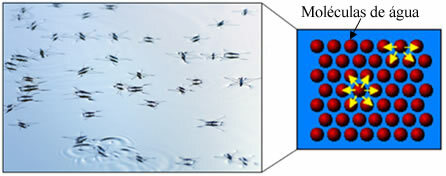
Además, el agua tiene algo llamado tensión superficial. Puedes entender esto mejor en el texto. Tensión superficial del agua, pero básicamente es una especie de película o membrana elástica que se forma en la superficie del agua, lo que evita que penetre en las telas y otros materiales para eliminar la suciedad. Las moléculas de agua se atraen en todas direcciones a través de enlaces de hidrógeno, pero las moléculas de la superficie solo interactúan con las moléculas en el lado y debajo, creando una diferencia en fuerzas de cohesión, lo que hace que las moléculas de la superficie se contraigan y formen esta tensión superficial.
Ahí es donde entran los jabones y detergentes (del latín
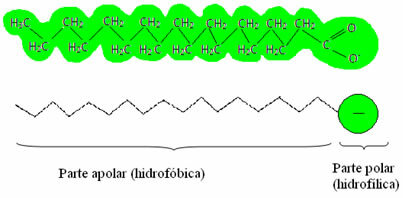
desintoxicar = claro), que también se llaman agentes tensioactivos, ya que tienen la capacidad de reducir la tensión superficial del agua y, además, interactúan tanto con el agua como con la grasa. ¿Como sucedió esto?Los jabones y detergentes tienen sales de ácidos grasos, que son moléculas largas formadas por un parte no polar (que es hidrofóbico – hidro = agua; fobias = aversión) y un extremo polar (hidrofílico – hidro = agua; phyla = amigo). A continuación tenemos una estructura típica de un jabón:
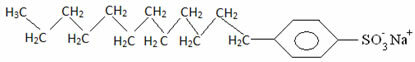
Generalmente, los detergentes son sales de ácidos sulfónicos de cadena larga:
Así, la parte no polar de estas moléculas presentes en jabones y detergentes interactúa con la grasa, mientras que el extremo polar interactúa con el agua, agrupándose en pequeños glóbulos, llamado desde micelas, en el que las partes hidrofílicas miran hacia el exterior de la micela en contacto con las moléculas de agua, y el la grasa permanece en el interior, en contacto con la parte no polar o hidrofóbica, proceso similar al que se muestra en la imagen a seguir:
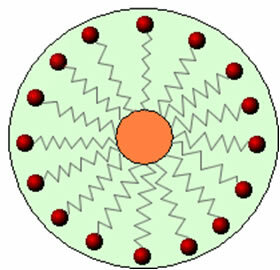
De esta forma, la suciedad grasa queda atrapada en el centro de las micelas y se puede eliminar. Otro punto es que los detergentes y jabones tienen la capacidad de reducir la tensión superficial del agua, porque Disminuir las interacciones entre sus moléculas, lo que le facilita la penetración de varios materiales para eliminar el tierra.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm
