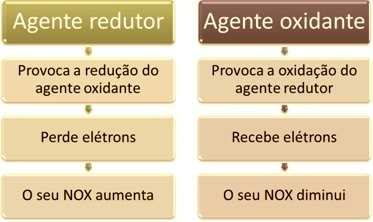
Una de las principales características que distinguen una reacción de oxidación-reducción (o redox) de los demás es la presencia de un agente oxidante y un agente reductor, que se pueden definir de la siguiente manera:
Por ejemplo, observe la siguiente reacción química en la que el aluminio (Al) se corroe en una solución acuosa de ácido clorhídrico (HCl). Los átomos de aluminio transfieren electrones a cationes H+(aquí) y producir el catión Al3+(aquí):
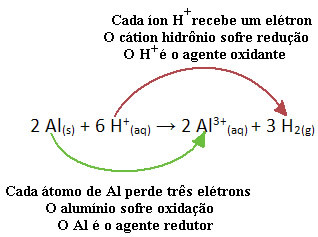
Tenga en cuenta que dado que Al transfirió electrones, esto significa que el causo la reduccion de los cationes H+(aquí); por eso se llama agente reductor. Ya el catión H+(aquí) eliminó los electrones del aluminio, causando oxidación de ese metal; por lo tanto, actúa como un agente oxidante.
En la vida cotidiana, hay muchos ejemplos del desempeño de agentes oxidantes y agentes reductores. Mire algunos de ellos y recuerde, sin embargo, que en todos los casos la reducción ocurre simultáneamente con la oxidación; por lo tanto, si hay un agente reductor, también hay un agente oxidante.
- Ejemplos de agentes reductores:
- En películas fotográficas: Las películas fotográficas contienen sales de plata sensibles a la luz. En los puntos donde hay incidencia de luz hay una reducción de iones Ag+, resultando en el contraste observado en los negativos.

- Vitamina C: La vitamina C (ácido L-ascórbico) es un poderoso agente reductor en solución acuosa. Tiene una facilidad excepcional para oxidarse y por eso es muy utilizado, especialmente en alimentos como un antioxidante, es decir, se añade a otros alimentos y los protege de una posible oxidación, por su propia sacrificio. Un ejemplo son las frutas como las manzanas y las peras que se oscurecen en contacto con el oxígeno del aire, porque se oxidan. Pero cuando agrega una pequeña cantidad de jugo de naranja o limón (que contiene vitamina C) a la fruta cortado, esto evita que se produzca esta reacción, porque la vitamina C actúa como agente reductor y se oxida antes que la fruta.

- Gas de hidrogeno: el gas hidrógeno (H2) se utiliza en la propulsión de cohetes y se considera una de las alternativas energéticas más importantes, ya que su combustión libera una gran cantidad de energía y no contamina. En esta reacción, el hidrógeno actúa como agente reductor, siendo oxidado por el oxígeno.
- Ejemplos de agentes oxidantes:
- En la producción de vinagre: cuando el vino se expone al aire, se convierte en vinagre, cuyo componente principal es el ácido acético. Esto se debe a que el alcohol etílico o el etanol presente en el vino se oxida al entrar en contacto con el oxígeno atmosférico, lo que produce ácido acético. Por tanto, el oxígeno es un agente oxidante. Incluso el origen del término "oxidación" está relacionado con la reacción con el oxígeno.

- En el óxido: como se indicó en el ejemplo anterior, el oxígeno actúa como un agente oxidante para el alcohol; y lo hace también en contacto con varios metales, como el hierro, provocando el proceso de oxidación. Además del oxígeno en el aire, otros agentes oxidantes en este caso son el agua o una solución ácida.
- En lejías: el efecto blanqueador de los blanqueadores se debe a la presencia de los dos agentes reductores siguientes: o anión hipoclorito (generalmente en forma de sal sódica - NaOCl), presente, por ejemplo, en lejía; y peróxido de hidrógeno (H2O2), comercializado como peróxido de hidrógeno. Estos dos compuestos tienen una tendencia muy fuerte a oxidarse y provocar la reducción de otras especies químicas. Por lo tanto, son responsables de las sustancias oxidantes que imparten un color oscuro a los productos. Por ejemplo, en la celulosa, la lignina se degrada y se vuelve más ligera y maleable. En el caso de quitamanchas y blanqueadores de tejidos, estos agentes oxidantes provocan la oxidación de moléculas orgánicas como grasas y tintes.

- En alcoholímetros: un alcoholímetro simple desechable consiste en un tubo transparente que contiene una solución acuosa de la sal dicromato de potasio y sílice, humedecida con ácido sulfúrico; mezclado con color naranja. Esta sal, en contacto con el vapor de alcohol contenido en el aliento del conductor ebrio, reacciona cambiando el color a verde. Esto significa que se produce la oxidación del etanol (alcohol) a etanal.

Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm


