LA estereoisomería, también conocido como Isomería espacial, es un tipo de isomería en el que sus isómeros se diferencian por la disposición de los enlaces entre sus átomos de manera diferente en el espacio.
Hay dos tipos de estereoisómeros, el diastereoisómeros y los enantiómeros. Los diastereoisómeros son isómeros geométricos del tipo cis-trans, que no son imágenes especulares entre sí, mientras que los enantiómeros son isómeros ópticos que son imágenes especulares entre sí.
Hablando un poco sobre el diastereoisómero cis-trans, solo ocurre en compuestos insaturados o cíclicos. ¿Por qué no ocurre en compuestos de cadena saturada, es decir, que solo tienen enlaces simples entre carbonos?
Puede suceder que nos confundamos pensando que ciertos compuestos saturados son diastereoisómeros, cuando en realidad representan el mismo compuesto. Por ejemplo, a continuación, tenemos tres conformaciones espaciales de los átomos de 1,2-dicloroetano:
H H H H H Cl
│ │ │ │ │ │
H — C — C — S.S — C — C — ClH — C — C — H
│ │ │ │ │ │
Cl ClCl H Cl H
¿Son estos tres diastereoisómeros? No hacer. En verdad, las tres moléculas son del mismo compuesto. Lo que sucede es que los enlaces simples o sigma (σ) entre los carbonos pueden sufrir rotaciones, lo que da como resultado diferentes arreglos atómicos.
Vea cómo sucede esto en el siguiente esquema con etano:

Estos compuestos, que en realidad son el mismo compuesto, no realizan isomería cis-trans geométrica, pero se denominan isómeros conformacionales, ya que difieren solo en la conformación de sus átomos causada por la rotación alrededor del enlace simple.
Una de las formas de representar estas moléculas para facilitar la visualización de la rotación del eje de conexión es a través del Proyección de Newman, en el que se considera como si el plano de visión estuviera exactamente en el eje del enlace entre los carbonos y están representados por un círculo central. Vea la proyección de Newman para el etano:

También podemos representar estas diferentes conformaciones a través de la fórmula en caballetes:
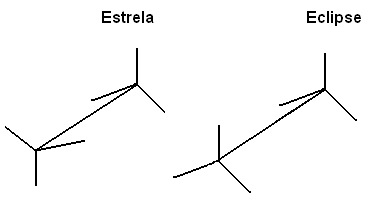
Esta rotación libre del eje de enlace ya no ocurre en compuestos insaturados o cíclicos. Por ejemplo, imagina que construimos un modelo simple, que representa dos carbonos por dos bolas de poliestireno conectadas por un palillo clavado en ellas.
Cuando tenemos un solo palillo y sujetamos una de las bolas, la otra puede girar fácilmente alrededor de su propio eje, tal como lo hace con una simple unión.

Sin embargo, si colocamos un palillo más conectando las dos esferas, no podremos sujetar una esfera y girar la otra. Si hacemos esto, los palillos se romperán. Asimismo, cuando hay un enlace pi y un sigma (doble enlace) existe un impedimento para la rotación de los carbonos.
Por tanto, en el caso siguiente, en el que tenemos un doble enlace entre los carbonos, no se trata de dos isómeros conformacionales, es decir, dos conformaciones para la misma molécula; en realidad tenemos dos diastereoisómeros cis-trans:
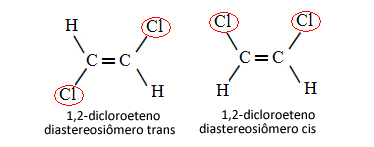
Ver más sobre este tipo de isomería en el texto Isómeros geométricos o cis-trans.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm
