Si fuera posible visualizar la estructura de un metal con mucha claridad, lo veríamos como en la imagen de arriba. La estructura atómica de los metales es cristalina, que consta de cationes metálicos rodeados de electrones.
Las redes cristalinas presentes en los metales se pueden representar de la siguiente manera: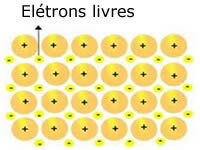
Representación de sodio metálico (Na)
Las redes cristalinas de los metales están formadas por un grupo de cationes fijos.
Cada catión de Na + está rodeado de electrones, pero estos están deslocalizados, es decir, no son atraídos por ningún núcleo.
Como no existe atracción entre las cargas negativas (electrón) y el núcleo positivo (catión), los electrones libres acaban ocupando toda la red cristalina del metal. La libertad que tienen los electrones para moverse hace que formen una nube electrónica.
La capacidad de los metales para conducir electricidad se explica por la presencia de esta nube. La corriente eléctrica resulta del contacto de electrones libres con otros metales.
En la composición de cualquier átomo, incluidos metales como Sodio (Na), Oro Au, Cobre (Cu), hay una capa de valencia. Los electrones se mueven libremente a través de esta capa manteniendo la atracción electromagnética de los cationes. Esta propiedad estructural permite la formación de moléculas metálicas y, en consecuencia, de los propios metales.
Por Líria Alves
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm