Un aldehído es cualquier compuesto orgánico que tiene un grupo carbonilo unido a un hidrógeno, es decir, su grupo funcional siempre proviene del final de una cadena de carbono y está dado por:
O
│ ║
─ C ─ C ─ H
│
Grupo funcional
de los aldehídos
Las cetonas son aquellos compuestos orgánicos que tienen un grupo carbonilo entre dos carbonos. Por lo tanto, su grupo funcional nunca aparecerá al final de una cadena de carbono.
O
│ ║ │
─ C ─ C ─ C ─
│ │
Grupo funcional
de cetonas
Cuando estos dos tipos de compuestos se exponen a agentes oxidantes, solo reaccionan los aldehídos. Esto se debe a que el carbono unido al oxígeno en el carbonilo adquiere un carácter positivo, ya que el oxígeno es más electronegativo y atrae los electrones del enlace químico con más fuerza.
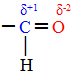
Por lo tanto, un oxígeno naciente que está en el medio atacará ese carbono, colocándose exactamente entre el enlace carbono-hidrógeno. En el caso de los aldehídos, se forma un compuesto del grupo de los ácidos carboxílicos, y en el caso de las cetonas, no hay reacción, porque su carbono carbonilo no está unido a ningún hidrógeno.
O O
║ ║
R C ─ H + [O] →R C ─ OH
Ácido carboxílico aldehído
O
║
R ─ C ─ R + [O] →no reacciona
cetona
Así, es muy común en el laboratorio realizar reacciones de oxidación para identificar si una determinada sustancia es un aldehído o una cetona. Entre los oxidantes que se utilizan comúnmente se encuentran los Tollens reactivo (solución acuosa de amoniaco de nitrato de plata), la Fehling reactivo (solución acuosa de sulfato de cobre en medio básico y doble tartrato de sodio y potasio) y Benedict's reactivo (solución acuosa de sulfato de cobre en medio básico y citrato de sodio).
El reactivo de Benedict se utiliza principalmente en cintas de papel para detectar la presencia y concentración de glucosa (un polialcohol-aldehído) en la orina.
Algo interesante sucede cuando se usa el reactivo de Tollens para oxidar un aldehído, se forma un espejo plateado en las paredes del recipiente. Esto se debe a que el aldehído se oxida a ácido carboxílico, mientras que los iones de plata (Ag+) se reducen a Ag0 (plata metalizada), que se deposita en las paredes del contenedor.
Vea cómo se puede representar esta reacción en el caso de que el propanal se oxide a ácido propanoico:
O O
║ ║
H3C CH2 ─ C ─ H + H2O → H3C CH2 ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║ ║
H3C CH2 ─ C ─ H + 2 Ag+ + 2 NH3 + H2O → H3C CH2 ─ C ─ OH + 2 Ag0 + 2 NH4+
propano Tollens reactivoácido propanoico plata metálica
(aldehído)(solución acuosa de amoniaco(ácido carboxílico) (espejo de plata)
de nitrato de plata)
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/reacao-oxidacao-aldeidos-cetonas.htm


