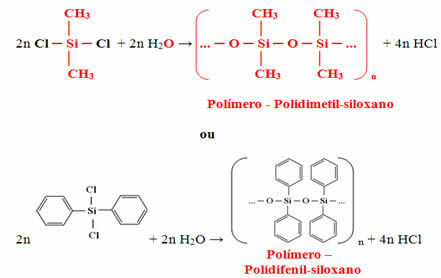
Hacia familias de la tabla periodica son las secuencias verticales de la tabla y se juntan elementos químicos con propiedades químicas similares. Tales similitudes se deben a la presencia de cantidades iguales de electrones de valencia para los elementos agrupados en la misma familia. Las familias acomodan los elementos representativos en los grupos 1 y 2, del 13 al 18 y los elementos de transición en los grupos 1 al 12.
Lea también:Elementos transuránicos: los elementos químicos hechos por el hombre que vienen después del uranio en la tabla periódica.
Resumen de familias de tablas periódicas
Las familias corresponden a las líneas verticales de los Tabla periodica.
También conocidas como grupos, las familias en la Tabla Periódica están numeradas del 1 al 18.
Los elementos químicos de la misma familia tienen propiedades químicas similares.
La familiaridad de un conjunto de elementos se explica por tener igual número de electrones de valencia.
Los elementos representativos se dividen en los grupos 1, 2, 13, 14, 15, 16, 17 y 18. Cada una de estas familias tiene nombres específicos.
Los elementos de transición forman una sola familia que se divide en los grupos 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12.
Organización de las familias de la Tabla Periódica
Familias en la Tabla Periódica son las sucesiones verticales de la tabla, es decir, las columnas. También conocidas como grupos, las familias de la Tabla Periódica están numerados del 1 al 18, de izquierda a derecha.
Los elementos químicos que ocupan la misma columna se consideran de la misma familia., debido a la similitud entre sus propiedades químicas, que se debe a que tienen el mismo número de electrones en capa de valencia. Por ejemplo, todos los elementos químicos de la familia 18 tienen ocho electrones en la capa de valencia (capa completa) y rara vez participan en enlaces químicos.
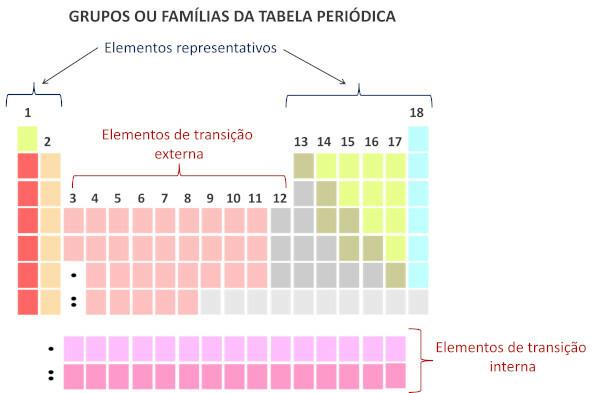
Según el moderno sistema de Unión internacional de Química Pura Aplicada (Iupac), cada grupo o familia se identifica con un número del 1 al 18, comenzando de izquierda a derecha en la Tabla Periódica.
Es importante resaltar que el antiguo sistema IUPAC adoptó un sistema alfanumérico, con las letras A y B para referirse a los elementos representativos y de transición, respectivamente. Actualmente, este tipo de nomenclatura ya no se utiliza.
Nomenclatura de las familias de la Tabla Periódica
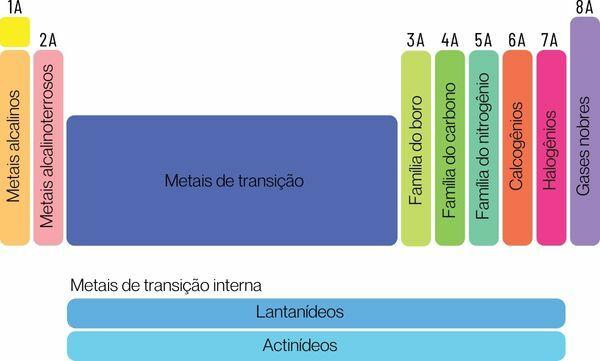
Los elementos químicos se pueden clasificar en dos grandes familias: elementos representativos y elementos de transición.
→ Elementos representativos de la Tabla Periódica
Los elementos representativos se dividen en los grupos 1, 2, 13, 14, 15, 16, 17 y 18. Cada uno de estos grupos tiene un nombre específico, por el cual también se le puede conocer. Vea:
Grupo 1: familia de rieles alcalino.
Grupo 2: familia de metales alcalinotérreos.
Grupo 13: familia de los metales boro o tierra.
Grupo 14: familia de carbono.
Grupo 15: Nitrógeno o familia Pnicogens.
Grupo 16: familia del oxígeno o de los calcógenos.
Grupo 17: familia de halógenos.
Grupo 18: familia de Gases nobles.
→ Elementos de transición de la tabla periódica
Tú elementos de transiciónformar una sola familia dividida en grupos 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12. Las series de lantánidos y actínidos también forman parte de los elementos de transición.
Los elementos de transición son todos metálicos y tienen propiedades químicas similares, incluso teniendo diferentes electrones en la capa de valencia y, por tanto, formarían una única y numerosa familia de metales de transición.
Elementos químicos de las familias de la Tabla Periódica
Cada familia o grupo está compuesto por un conjunto de elementos químicos. Ver la descripción de los elementos químicos que componen cada familia:
Grupo 1:litio, sodio, potasio, rubidio, cesio, francio.
Grupo 2:berilio, magnesio, calcio, estroncio, bario, radio.
Grupo 3:escandio, itrio, serie de lantánidos y serie de actínidos.
Grupo 4: titanio, circonitaO, hafnio Es rutherfordio.
Grupo 5:vanadio, niobio, tantalio Es dubnio.
Grupo 6:cromo, molibdeno, tungsteno Es seaborgio.
Grupo 7:manganeso, tecnecio, renio Es bohrio.
Grupo 8: hierro, rutenio, osmio Es hassio.
Grupo 9:cobalto, rodio, iridio y meitnerio.
Grupo 10:níquel, paladio, platino y darmstadtio.
Grupo 11: cobre, plata, oro y roentgenio.
Grupo 12:zinc, cadmio, Mercurio y Copérnico.
Grupo 13: boro, aluminio, galio, indio y talio.
Grupo 14: carbón, silicio, germanio, estaño, Plomo y flerovio.
Grupo 15:nitrógeno, fósforo, arsénico, antimonio Es bismuto.
Grupo 16:oxígeno, azufre, selenio, telurio, polonio y livermorio.
Grupo 17: flúor, cloro, bromo, yodo y astato.
Grupo 18:helio, neón, argón, criptón, xenón Es radón.
Importante: el elemento quimico hidrógeno es un caso particular, ya que a pesar de ubicarse junto al grupo 1, no forma parte de la familia de los metales alcalinos, ya que no comparte propiedades químicas similares.
Sepa mas: ¿Cuáles son los elementos radiactivos en la tabla periódica?
Principales características de las familias de la Tabla Periódica
→ Grupo 1 o familia de metales alcalinos
Son sólidos metálicos, brillantes y lisos.
Tienen alta conductividad térmica y alta Conductividad eléctrica.
tener temperaturas punto de fusión relativamente bajo.
Son altamente reactivos con agua.
Tendencia a formar cationes monovalentes (carga +1).
→ Grupo 2 o familia de metales alcalinotérreos
Son sólidos metálicos, brillantes y más duros que los metales alcalinos.
Se oxidan fácilmente.
Tienen alta conductividad térmica y alta conductividad eléctrica.
Tienen temperaturas de fusión ligeramente más altas en comparación con los metales alcalinos.
Son reactivos con el agua.
Tendencia a formar cationes divalentes (carga +2).
→ Grupos 3 a 12 o familia de metales de transición
Son la familia más numerosa de la tabla periódica.
Sólidos metálicos duros y brillantes.
Tienen alta conductividad térmica y alta conductividad eléctrica.
Denso.
Altas temperaturas de fusión.
puede presentar diferentes estados de oxidación.
→ Grupo 13 o familia del boro
Tienen propiedades intermedias entre las propiedades de los metales y no metales.
Son sólidos en condiciones ambientales.
Tendencia a formar cationes trivalentes (carga +3).
→ Grupo 14 o familia de carbono
Tienen propiedades intermedias entre las propiedades de los metales y los no metales.
Son sólidos en condiciones ambientales.
Tendencia a formar cuatro enlaces.
Son sólidos en condiciones ambientales.
El carbono y el silicio pueden formar enlaces en cadena.
→ Grupo 15 o familia nitrogenada
Tienen propiedades intermedias entre las propiedades de los metales y los no metales.
Sólidos en condiciones ambientales, a excepción del nitrógeno, que es un gas.
El nitrógeno y el fósforo son fundamentales en los organismos vivos.
El arsénico es altamente tóxico.
→ Grupo 16 o familia del oxígeno (calcógenos)
Tienen diferentes propiedades, cambiando de elementos no metálicos a elementos metálicos a medida que avanza en la familia.
Sólidos en condiciones ambientales, a excepción del oxígeno, que es un gas.
Tendencia a formar aniones divalentes (carga -2).
→ Grupo 17 o familia de halógenos
Son no metales.
Bastante reactivo.
Malos conductores térmicos y eléctricos.
En condiciones ambientales, el flúor y el cloro existen como gases, el bromo es líquido y el yodo es sólido.
Tendencia a formar aniones monovalentes (carga -1).
→ Grupo 18 o familia de gases nobles
Son no metales.
Muy poco reactivos, por lo que se les puede llamar gases inertes.
Existen en forma de gases.
No tienen tendencia a formar iones.
Tabla periódica y distribución electrónica
Los elementos químicos que pertenecen a la misma familia o grupo tienen propiedades químicas similares porque tienen igual número de electrones en la capa de valencia.
El número de electrones en la capa de valencia es relevante, ya que determina la tendencia a la formación de cationes o aniones, el tipo de enlace químico a formar, la energía involucrada en las reacciones químicas, entre otros características. Para encontrar el número de electrones de valencia, es necesario saber el número atómico del elemento y realizar su distribución electrónica.
→ Distribución electrónica de elementos representativos
Los elementos representativos tienen sus electrones más energéticos en subniveles s Es PAG de la capa electrónica (n). La siguiente tabla reúne las configuraciones electrónicas asociadas a cada familia de elementos representativos. El término norte varía de 1 a 7 y representa el nivel de energía ocupado por los electrones de valencia, equivalente al período (línea horizontal) de la Tabla Periódica en que se encuentra el elemento.
Distribución electrónica de elementos representativos | ||
familia o grupo |
distribución electrónica |
Ejemplo |
1 |
a nosotros1 |
Li (Z=3): 1s2 2s1 |
2 |
a nosotros2 |
Ser (Z=4): 1s2 2s2 |
13 |
a nosotros2 notario público1 |
Segundo (Z=5): 1s2 2s22p1 |
14 |
a nosotros2 notario público2 |
C (Z=6): 1s2 2s22p2 |
15 |
a nosotros2 notario público3 |
N (Z=7): 1s2 2s22p3 |
16 |
a nosotros2 notario público4 |
O (Z=8): 1s2 2s22p4 |
17 |
a nosotros2 notario público5 |
F (Z=9): 1s2 2s22p5 |
18 |
a nosotros2 notario público6 |
Ne (Z=10): 1s2 2s22p6 |
→ Distribución electrónica de elementos de transición
Los elementos de transición se distribuyen entre los grupos 3 y 12 y tener los subniveles d Es F ocupado por electrones de valencia:
Elementos de transición externos: mantener los electrones de valencia en el subnivel d, manteniendo la configuración electrónica igual a a nosotros2 (n-1)d(1 a 8). Por ejemplo, el elemento níquel (Z = 28) pertenece al grupo 10 y su configuración es 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Elementos de transición interna: forman parte del grupo 3, pero son “internos” a la Tabla Periódica, expandiéndose por debajo de ella, en los períodos 6 (lantánidos) y 7 (actínidos). Estos elementos tienen electrones de valencia que ocupan la subcapa. F y configuración electrónica general de a nosotros2 (n-2)f(1 a 13). Por ejemplo, el elemento lantano (Z = 57) es el primer elemento de la serie de los lantánidos y su configuración electrónica es 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Conoce también:¿Cuál es el origen de la tabla periódica?
Ejercicios resueltos sobre las familias de la Tabla Periódica
Pregunta 1
(UFC — adaptado) Con respecto a la clasificación periódica moderna de los elementos, marque la afirmación verdadera:
A) En la Tabla Periódica, las familias o grupos corresponden a líneas horizontales.
B) Los elementos de una familia tienen propiedades químicas muy diferentes.
C) En una familia, los elementos generalmente tienen el mismo número de electrones en la última capa.
D) En un período, los elementos tienen propiedades químicas similares.
E) Los elementos representativos se distribuyen en los grupos 3 a 12.
Resolución:
Alternativa C
El ítem A es incorrecto: las familias o grupos son las columnas (líneas verticales) de la Tabla Periódica.
Elementos B y D incorrectos: en una familia, los elementos tienen propiedades químicas similares. En períodos, los elementos tienen la misma capa de electrones ocupada por electrones de valencia.
Ítem C correcto: En una familia, los elementos tienen el mismo número de electrones en la última capa.
Ítem E incorrecto: los elementos representativos son los grupos 1, 2, 13, 14, 15, 16, 17 y 18. Los elementos de transición se distribuyen en los grupos 3 a 12.
Pregunta 2
(EAM) Los elementos A, B y C tienen las siguientes configuraciones electrónicas en sus capas de valencia:
R: 3s1
segundo: 4 segundos2 4p4
do: 3s2
Con base en esta información, seleccione la opción correcta.
A) El elemento A es un metal alcalino.
B) El elemento B es un halógeno.
C) El elemento C es un calcógeno.
D) Los elementos A y B pertenecen al tercer período de la Tabla Periódica.
E) Los tres elementos pertenecen al mismo grupo de la Tabla Periódica.
Resolución:
Alternativa A
Ítem A correcto: el elemento A tiene una distribución electrónica que contiene solo un electrón de valencia, por lo tanto pertenece al grupo 1 de la Tabla Periódica.
Elemento B incorrecto: el elemento B tiene una configuración electrónica 4s2 4p4, indicando que hay 6 electrones en la última capa y que este elemento pertenece al grupo 16 (calcógenos).
Ítem C incorrecto: el elemento C tiene una configuración electrónica con 2 electrones en la última capa, por lo que es un elemento del grupo 2 de la tabla.
Ítem D incorrecto: el elemento A pertenece al tercer período (n = 3), y el elemento B pertenece al cuarto período (n = 4).
Ítem incorrecto E: los tres elementos tienen diferentes cantidades de electrones en la última capa, por lo que no pueden ser parte de la misma familia.
Por Ana Luisa Lorenzen Lima
Profesor de química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm