O moscovio, número atómico El 115, ubicado en el grupo 15 de la Tabla Periódica, es uno de los últimos elementos incluidos en ella, en 2015, junto con los elementos 113, 117 y 118. Su nombre es una referencia a la región de Moscú, capital rusa.
Moscovium, sin embargo, se produjo inicialmente, en 2003, gracias al trabajo conjunto de científicos rusos y estadounidenses. Aun así, casi 20 años después de su síntesis inicial, aún se están determinando sus propiedades básicas. Así, mucho se especula y poco se sabe sobre sus propiedades.
Sepa mas: Nombres de los nuevos elementos químicos: los tributos a ciudades, regiones y científicos
Temas de este artículo
- 1 - Resumen sobre Moscovia
- 2 - Propiedades del moscovio
- 3 - Características del moscovio
- 4 - Obtención del Moscovio
- 5 - Historia de Moscovia
- 6 - Ejercicios resueltos sobre moscovio
resumen sobre moscovio
Es un elemento químico sintético ubicado en el grupo 15 de Tabla periodica.
Fue sintetizado por primera vez, en 2003, mediante un trabajo conjunto entre científicos rusos y estadounidenses.
Conforma el grupo de elementos incluidos más recientemente en la Tabla Periódica, en 2015.
Sus estudios son muy recientes y aún se están determinando las propiedades básicas.
Su producción se realiza por fusión nuclear, utilizando 48Ca y átomos de 243Soy.
No pares ahora... Hay más después de la publicidad ;)
Moscú propiedades
Símbolo: Mc
Número atómico: 115
Masa atomica: 288 au.m.a (no oficial por Iupac)
Configuración electrónica: [Rn] 7s2 5f14 6d10 7p3
Isótopo más estable: 288Mc (0,159 segunda vida media)
serie química: grupo 15, elementos superpesados
Características de Moscovia
el moscovio es uno de los últimos elementos incluidoss en la Tabla Periódica. Su inclusión se produjo el 30 de diciembre de 2015, siendo su nombre oficial el 8 de junio de 2016.
Hasta esa fecha, el elemento 115 era conocido en portugués como ununpentio, del latín, ununpentium, cuya traducción es “uno, uno, cinco”. Otra nomenclatura adoptada fue eka-bismuto, que significa "similar al bismuto", elemento del sexto período del grupo 15.
El Moscovia es un elemento sintético, lo que significa que solo se puede producir en un laboratorio. Esto es muy común entre los elementos superpesados porque su núcleo, con muchos protones y neutrones, no puede estabilizarse, por lo que es imposible encontrarlos en la naturaleza.
por ser un elemento inestable, él y los otros elementos superpesados terminan experimentando una desintegración radiactiva casi instantáneamente: emisiones de partículas elementos nucleares (como las partículas α o β), y la consiguiente transformación en otros elementos más ligeros, que pueden ser estables o No.
Respecto a él, cabe señalar que sus estudios aún son muy recientes, al fin y al cabo, estamos ante un elemento producido hace poco menos de 20 años y cuya oficialidad no llega ni a los 10 años. En este sentido, los científicos se han preocupado más por determinar características básicas, como su masa atomica y su comportamiento químico en algunos posibles compuestos.
Por ejemplo, la masa atómica más probable detectada hasta ahora para muscovy es de 288 unidades de masa atómica. Sin contar que la obtención del moscovio es muy complicada, con un ingresos de una sola átomo por dia.
Además, el átomo producido no siempre puede capturarse para medir la masa. En 2018, investigadores de Berkeley Laboratories, California, Estados Unidos, pudieron medir solo una masa por semana. De ese modo, los estudios sobre las propiedades de sus compuestos aún se encuentran en el campo de la química teórica, con cálculos y modelos matemáticos para determinar los resultados esperados.
Obtención del Moscovia
La obtención del moscovio se realiza mediante Fusión nuclear. iones de 48Aquí11+ (Z = 20) átomos de golpe acelerado de 243Am (Z = 95), dispuesta en forma de AmO2 en un objetivo circular titanio de 32 cm², produciendo el moscovio (Z = 115) y tres neutrones.
Después del impacto, en aproximadamente un microsegundo (10-6 segundo), el átomo de muscovy golpea el detector, que está a unos cuatro metros del lugar de la colisión. En este camino, el elemento también pasa a través de un separador, de modo que se desvían los productos de reacción más ligeros. En el detector, el moscovio se detecta por su patrón de desintegración radiactiva.
El moscovio, como átomo radiactivo, sufre una desintegración alfa (una partícula radiactiva con dos protones y dos neutrones), produciendo así el elemento 113 (nihonio, Nh) al elemento 105 (dubnio, DB). Finalmente, el Db se convierte en el rutherfordio (Rf), que se divide en dos fragmentos rápidamente. El patrón de descomposición del moscovio se muestra a continuación.
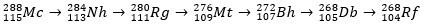
historia de moscú
el moscovio era sintetizado por primera vez en 2003, entre el 14 de julio y el 10 de agosto, a través del trabajo conjunto de científicos del Joint Institute para la Investigación Nuclear en Dubna, Rusia, y el Laboratorio Nacional Lawrence Livermore en Livermore, California.
Iones de 48Ca para que puedan chocar con los átomos de 243Am, produciendo inicialmente el isótopo 291Mc. Durante el proceso, el núcleo se calentó a un increíble 4 x 1011 K, y luego enfriado por la emisión muy rápida de tres neutrones y rayos gamma.

Esta acción formó el isótopo 288Mc. entonces el moscovio fue detectado y analizado en base a su patrón de desintegración radiactiva (alfa decae). El nombre Moskow es un tributo a la región de Moscú, Rusia.
Lea también:Seaborgio: el elemento químico sintético que lleva el nombre del científico Glenn Seaborg
Ejercicios resueltos sobre muscovius
Pregunta 1
Moscovium, un elemento recientemente descubierto, se colocó en el grupo 15 de la Tabla Periódica. Con base en los otros elementos de este grupo, el hidruro esperado para este elemento sería:
A) McH
B) MCH2
C) McH3
D) McH4
En c2H3
Resolución:
Alternativa C
Otros elementos del grupo 15, como nitrógeno Es fósforo, presente las fórmulas NH3 y pH3 cuando se une al hidrógeno. Así, se espera que el moscovio presente la fórmula McH3 también.
Pregunta 2
En 2003, se sintetizó por primera vez moscovio (Z = 115), gracias al trabajo conjunto de científicos rusos y estadounidenses. En ese momento, el isótopo 288Mc fue detectado y su producción fue fundamental para colocar este elemento en la Tabla Periódica. El número de neutrones en este isótopo es:
A) 115
B) 288
c) 403
D) 173
mi) 170
Resolución:
Alternativa D
El número de neutrones se puede calcular asi:
A = Z + norte
Donde A es el número de masa, Z es el número atómico y n es el número de neutrones. Sustituyendo los valores, obtenemos:
288 = 115 + norte
n = 288 – 115
n = 173
Por Stefano Araújo Novais
Profesor de química
¿Alguna vez has oído hablar del elemento químico antimonio? Haz click aquí y conoce sus características, propiedades, obtención, aplicaciones e historia.
¿Alguna vez has oído hablar del elemento químico arsénico? Haz clic aquí, conoce sus principales características y conoce qué precauciones se deben tomar con él.
¿Alguna vez has oído hablar del elemento químico bismuto? Haz click aquí y conoce sus características, propiedades, obtención, aplicaciones e historia.
Descubre qué son los elementos transuránicos sintetizados en el laboratorio, cómo fueron descubiertos y su ubicación en la Tabla Periódica.
Conoce más sobre el fósforo así como sus características, propiedades, aplicaciones, precauciones, importancia e historia, así como el ciclo del fósforo.
Haz click y conoce la historia, características, fuentes, formas de obtención y usos del Nitrógeno.
Aprende en este texto cuáles son los nombres de los nuevos elementos químicos y por qué cada uno ha recibido tales nombres.
Descubre las principales características de los cuatro nuevos elementos de la Tabla Periódica.
