El científico Friedrich Kohlrausch (1840-1910) fue el primero en proponer que el agua pura conduce la electricidad, aunque a pequeña escala. Esto se debe a que el agua se comporta de forma anfótera; es decir, en determinadas ocasiones actúa como ácido, donando protones (H+); y en otros se comporta como una base, recibiendo protones.
Esto significa que el agua realiza su propia ionización, de acuerdo con la ecuación química que se muestra a continuación:
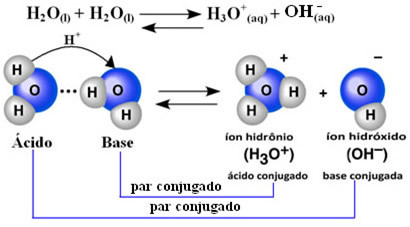
Este proceso se llama autoionización de agua y ocurre a muy pequeña escala, es decir, el agua es un electrolito muy débil, con valores bajos de grado de ionización y constante de ionización en equilibrio (KC). Esta es exactamente la razón por la que el agua tiene una conductividad tan baja.
Para hacerse una idea, a una temperatura ambiente de 25 ° C es posible determinar que las concentraciones de iones hidróxido e hidronio producidas en la autoionización del agua pura son iguales a 1. 10-7 mol. L-1. Esto significa que de mil millones de moléculas de agua, solo dos se ionizan.
La constante de equilibrio iónico del agua se llama Cconstante de disociación del agua,constante de autoprotolisiso producto iónico del agua.Esta constante está representada por Kw, porque la w se refiere a la palabra agua, que en inglés significa agua.
Su cálculo se realiza de la misma forma que las demás constantes de equilibrio, recordando que, como se indica en el texto "Constantes de Balance Kc y Kp ”, en este caso solo aparecerán los productos en la expresión, porque el agua en estado líquido tiene la misma actividad. a 1. Las sustancias líquidas o sólidas puras no se ponen en la expresión constante de disociación porque no cambian. Solo se colocan soluciones acuosas y gaseosas. Entonces tenemos:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Al igual que con las otras constantes de equilibrio, OKw solo cambia con el cambio de temperatura. A medida que aumenta la temperatura del agua, también aumenta su ionización, lo que significa que la autoionización del agua es un proceso endotérmico, es decir, absorbe calor.
Esto se puede ver en los valores del producto iónico del agua (Kw) que se indican en la siguiente tabla a diferentes temperaturas:
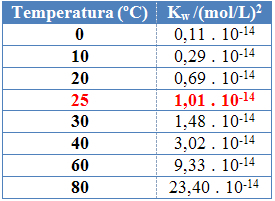
El producto iónico del agua siempre tendrá un valor fijo a cada temperatura, ya sea en agua pura o en solución. Incluso si la solución tiene concentraciones de iones H3O+ y oh- diferente, el producto entre ellos se mantendrá constante.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
