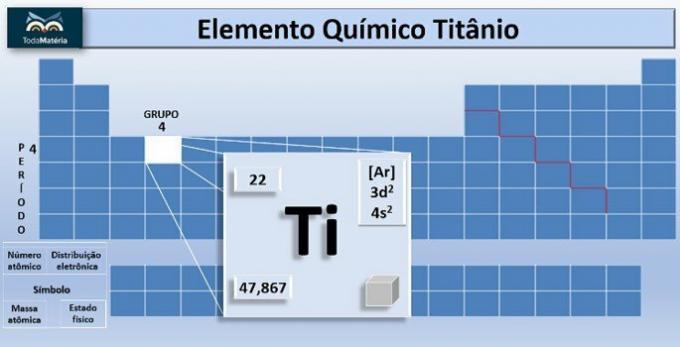
O titanio es el elemento químico de símbolo Ti y número atómico, es decir, número de protones igual a 22. Este metal se encuentra en el grupo 4 y 4 de la tabla periódica.
La masa atómica del elemento es 47.867 u, y debido a que tiene 22 electrones en los electrones del átomo, su distribución de electrones es 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
El titanio tiene propiedades deseables para numerosas aplicaciones, ya que es tan resistente como el acero y mucho más ligero.
Por ser un metal dúctil, refractario, resistente a la corrosión, presenta resistencia mecánica, estabilidad térmica y baja reactividad, se añade a las aleaciones metálicas para que tengan una alta actuación. Su biocompatibilidad y no toxicidad también lo hacen útil para la fabricación de prótesis óseas.
Las principales características del titanio son:
- Punto de fusión: 1668 °C
- Punto de ebullición: 3287 °C
- Densidad: 4,5 g/cm3
- Color: gris plata
- Estado físico a 20 °C: sólido
- Isótopos: Ti46, tú47, tú48, tú49 y usted50
Este elemento químico fue descubierto por el inglés William Gregor en 1791 y su nombre, derivado del griego
titanes, fue posteriormente atribuido por Martin Heinrich Klaproth.El titanio es el noveno elemento más abundante del planeta y se encuentra en la corteza terrestre en minerales como el rutilo (TiO2) e ilmenita (FeTiO3). Por lo tanto, la minería es el principal método de obtención de este metal.
¿Para qué se usa el titanio?
Debido a que no es químicamente reactivo a temperatura ambiente, se moldea fácilmente y tiene una alta resistencia mecánica y a la corrosión, el titanio se utiliza como un metal estratégico.
Las industrias aeronáutica y aeroespacial son los principales usuarios de titanio para la producción de piezas, como componentes de turbinas y fuselajes. Otras aplicaciones son la fabricación de prótesis dentales, implantes quirúrgicos y joyería.
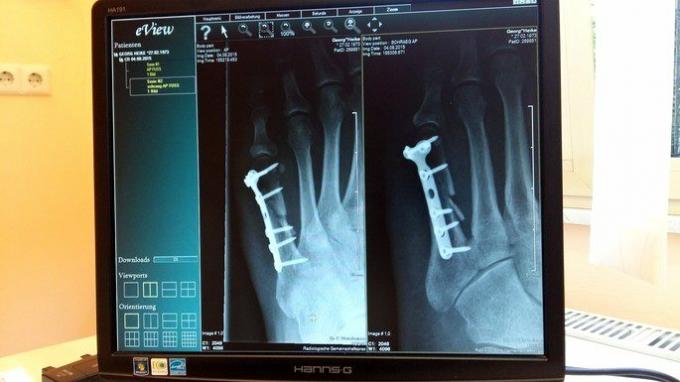
En medicina, el titanio es muy útil por su compatibilidad con los tejidos humanos, ligereza y resistencia. Se utiliza para la producción de implantes para partes del cuerpo, como tornillos de fijación, prótesis de rodilla, prótesis de húmero, prótesis de cadera, entre otros.
Dióxido de titanio (TiO2) es uno de los principales compuestos de este elemento, siendo utilizado como agente blanqueador. Generalmente, las tintas blancas de alta calidad lo utilizan para mejorar la apariencia visual del color y el brillo. Otros productos, como las pastas dentales y los protectores solares, también utilizan el pigmento. También tiene aplicación como colorante alimentario añadido en productos lácteos, dulces y bebidas.
En arquitectura, podemos ver el uso de titanio para cubrir estructuras curvas en el Museo Guggenheim de Bilbao, en el norte de España.

En el día a día podemos encontrar numerosos productos que tienen titanio en su composición, como cuadros de bicicletas, gafas y raquetas de tenis.
En la industria química, el titanio se utiliza como catalizador de reacciones. De esta forma, permite controlar la velocidad de reacción y reducir el tiempo de formación del producto sin afectar la composición de las sustancias.
La industria del automóvil ha estudiado la incorporación de titanio en la fabricación de automóviles para reducir su masa y, por tanto, reducir el consumo de combustible y aumentar su aceleración.
Adquiere más conocimientos con los contenidos:
- Elementos químicos
- Tabla periodica
- ¿Qué son los metales?
Referencias bibliográficas
ATKINS, PW; JONES, L. Principios de la química: cuestionando la vida moderna y el medio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, R. Fundamentos de Química: vol. único. 4ª ed. São Paulo: Moderna, 2005.
Lee, j. D. Química inorgánica no tan concisa. Traducción de la 5ª ed. Inglés. Editorial Edgard Blucher Ltd. 1999.



