La principal característica distintiva de las reacciones redox es que simultáneamente una especie química pierde electrones (por oxidación) y otra gana electrones (por reducción).
Sin embargo, en determinadas reacciones se puede observar que no solo se produce una oxidación y / o reducción. A continuación se muestra un ejemplo:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Calculando los números de oxidación (Nox) de todos los átomos en esta reacción, como se enseña en el texto “Determinación del Número de Oxidación (Nox)”, tenemos:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Veamos ahora cuálessustancias sufrieron variaciones en su Nox y, en consecuencia, que oxidaron y redujeron:
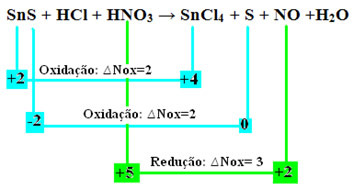
Tenga en cuenta que se han producido dos oxidaciones. Entonces, en ese caso, ¿cómo equilibrar la ecuación química?
Una cosa importante a tener en cuenta que se aplica a todas las reacciones redox es que el número de electrones entregados siempre debe ser igual al número de electrones recibidos.
Por tanto, para equilibrar este tipo de reacciones, siga las mismas reglas establecidas en el texto "Equilibrio redox”, Sin embargo, con un solo cambio: La determinación de la variación de Nox (∆Nox) de la especie que generó las dos oxidaciones (SnS) será la suma de los dos ∆Nox, lo que nos dará el valor total de los electrones perdidos:
- SnS: ∆Nox total = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆NOx total = 2 + 2 = 4
- HNO3: ∆Nox = 3
Entonces, podemos continuar con los siguientes pasos para equilibrar:
No pares ahora... Hay más después de la publicidad;)
- SnS: ∆NOx total = 4 → 4 será el coeficiente de HNO3;
- HNO3: ∆Nox = 3 → 3 será el coeficiente de SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2O
Continuación del equilibrado por método de prueba:
- Dado que tiene 3 Sn y 3 S en el primer miembro, estos también serán sus coeficientes en el segundo miembro:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y + NO + H2O
- Con eso, el segundo miembro se quedó con 12 Cl (3. 4 = 12), por lo que 12 será el coeficiente de la sustancia en la que el Cl se encuentra en el primer miembro, que es el HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO + H2O
- Ahora tenemos 16 H en el primer miembro (12 + 4 = 16), de ahí el coeficiente de H2O será igual a 8, porque 8 multiplicado por el índice de hidrógeno, que es 2, da 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Además, en el primer miembro también hay 4 N, por lo que 4 también será el coeficiente de N en el segundo miembro:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2O
Tenga en cuenta que la cantidad de oxígeno en la primera rama (3. 4 = 12) es igual a la cantidad total de ese elemento en la segunda rama (4 + 8 = 12). Entonces la reacción está equilibrada.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Reacciones con más de una oxidación y / o reducción"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Consultado el 27 de julio de 2021.