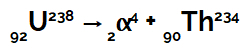variación de entalpía es una cantidad física representada por la abreviatura ΔH (la letra griega Δ significa variación y la letra H representa entalpía) que indica la cantidad de energía absorbida o liberada por un reacción química.
Reacción endotérmica: cuando se absorbe energía;
Reacción exotérmica: cuando se libera energía.
Expresión para calcular el cambio de entalpía
Como ocurre con todas las variaciones trabajadas en Física, la variación de entalpía se determina a partir de la resta entre el resultado final y el inicial. Como el final de una reacción corresponde a los productos y el comienzo corresponde a los reactivos, por lo tanto:
ΔH = Productos - Reactivos
Como toda sustancia química tiene una cantidad específica de energía (entalpía), para calcular la variación de entalpía, es necesario tener en cuenta la cantidad de energía de cada miembro de la reacción, de la siguiente manera:
Reactivos: si la reacción tiene más de un producto, también se deben agregar sus entalpías;
Si una reacción presenta la siguiente ecuación:
A + 2 B →
La entalpía de los reactivos se obtendrá sumando la entalpía del reactivo A a la suma del doble de la entalpía de B (esto se debe a que hay 2 moles de B en la ecuación).
Hr = HA + 2.HB
Productos: si la reacción presenta más de un producto, se deben sumar sus entalpías;
Si una reacción presenta la siguiente ecuación:
A + 2 B → C + 3D
La entalpía de los reactivos vendrá dada por la suma de la entalpía del producto C con la suma de la triple entalpía de D (esto se debe a que hay 3 moles de D en la ecuación).
Hp = HC + 3.HD
Por tanto, la expresión para calcular el variación de entalpía viene dada por la resta entre la entalpía de los productos y la entalpía de los reactivos de una reacción química.
ΔH = Hp - Hr
Interpretación del resultado de la variación de entalpía
Como es una resta entre las entalpías de productos y reactivos, el resultado de la variación de entalpía puede ser positivo o negativo.
Negativo: cuando la entalpía de los reactivos es mayor que la de los productos.
Hr> Hp
Positivo: cuando la entalpía de los productos es mayor que la de los reactivos.
Hp> Hr
A partir del resultado de la variación de entalpía, podemos clasificar la reacción en endotérmico o exotérmico, según el siguiente criterio:
Endotérmico: cuando el resultado es positivo.
ΔH> 0
Exotérmico: cuando el resultado es negativo.
ΔH <0
Ejemplos de cómo determinar el cambio de entalpía de una reacción química
1er ejemplo (UFF-RJ): Considere los valores de entalpía predeterminados de formación (ΔHOF) en KJ.mol-1 a 25 ° C, de las siguientes sustancias:
CH4 (g) = -74,8
CHCl3 (1) = - 134,5
HCl(gramo) = - 92,3
Para la siguiente reacción:
CH4 (g) + 3Cl2 (g) → CHCl3 (1) + 3HCl(gramo)
El ΔHOF será:
a) - 151,9 KJ.mol-1
No pares ahora... Hay más después de la publicidad;)
b) 168,3 KJ.mol-1
c) - 673,2 KJ.mol-1
d) - 336,6 KJ.mol-1
e) 841,5 KJ.mol-1
Para determinar la variación de entalpía de esta reacción, debemos realizar los siguientes pasos:
1O Paso: Compruebe si la ecuación está equilibrada. Si no es así, debe estar equilibrado.
La ecuación proporcionada por el ejercicio está equilibrada, por lo que tenemos 1 mol de CH4 y 3 mol de Cl2 en los reactivos y 1 mol de CHCl3 y 3 moles de HCl en los productos.
2O Paso: Calcule la cantidad de entalpía de los productos (Hp), multiplicando la cantidad en mol por la entalpía suministrada y luego sumando los resultados:
Hp = producto CHCl3 + Producto HCl
Hp = 1. (- 134,5) + 3. (- 92,3)
Hp = -134,5 + (-276,9)
Hp = -134,5 - 276,9
Hp = - 411,4 KJ.mol-1
3O Paso: Calcule la cantidad de entalpía de los reactivos (Hr), multiplicando la cantidad en mol por la entalpía dada y luego sumando los resultados:
Nota: Como el Cl2 es una sustancia simple, por lo que su entalpía es 0.
Hr = reactivo CH4 + Reactivo Cl2
Hr = 1. (- 74,8) + 3. (0)
Hr = -74,8 + 0
Hr = -74,8 KJ.mol-1
4O Paso: Calcule el cambio de entalpía, utilizando los valores encontrados en los pasos anteriores en la siguiente expresión:
HOF = Hp - Hr
HOF = - 411,4 - (-74,8)
HOF = -411,4 + 74,8
HOF = -336,6 KJ.mol-1
Segundo ejemplo (UEM-PR): Es posible preparar oxígeno gaseoso en el laboratorio calentando cuidadosamente el clorato de potasio, de acuerdo con la reacción:
2KClO3 (s) → 2KCl(s) + 3O2 (g) ΔH = +812 KJ / mol
Suponiendo que la entalpía de KCl(s) vale +486 KJ / Mol y considerando el sistema a 25 ° C y 1 atm, ¿cuál es el valor de entalpía predeterminado de KClO?3 (s) en KJ / mol?
Para determinar la entalpía de uno de los componentes de la ecuación a partir del conocimiento de la variación de entalpía, debemos realizar los siguientes pasos:
1O Paso: Compruebe si la ecuación está equilibrada. Si no es así, debe estar equilibrado.
La ecuación proporcionada por el ejercicio está equilibrada, por lo que tenemos 2 mol de KclO3 en el reactivo, y 2 mol de KCl y 3 mol de O2 en los productos.
2O Paso: Calcule la cantidad de entalpía de los productos (Hp), multiplicando la cantidad en mol por la entalpía suministrada y luego sumando los resultados:
Nota: como la O2 es una sustancia simple, por lo que su entalpía es 0.
Hp = producto KCl + producto O2
Hp = 2. (+ 486) + 3. (0)
Hp = +972 + 0
Hp = 972 KJ.mol-1
3O Paso: Calcule la entalpía del reactivo KClO3, utilizando la variación de entalpía, proporcionada en el enunciado, y la entalpía de los productos calculada en el paso anterior, en la siguiente expresión:
HOF = Hp - Hr
812 = 972 - 2. (Hr)
2 horas = 972-812
2 horas = 160
Hr = 160
2
Hr = 80 KJ / mol
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "¿Qué es la variación de entalpía?"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-variacao-entalpia.htm. Consultado el 27 de julio de 2021.
Química

Termoquímica, Entalpía, Calor liberado, Reacción exotérmica, Reacción de combustión, Ambiente externo, Reacción endotérmica, Reacción Química, intercambio de energía, reactivos, emisión de luz, absorción de luz, calor, electricidad, componentes, estado físico, productos.