A reacciones de combustión están presentes en muchos aspectos de nuestra vida diaria. Por ejemplo, las principales fuentes de generación de energía resultan de la combustión o quema de ciertos combustibles, como el etanol, la gasolina, el carbón vegetal, entre otros. Además, la energía que necesitamos para sobrevivir y trabajar es el resultado de reacciones de combustión que tienen lugar dentro de nuestras células cuando “quemamos” los alimentos que ingerimos.
Pero, ¿qué se necesita para tener una reacción de combustión?
Se necesitan tres cosas:
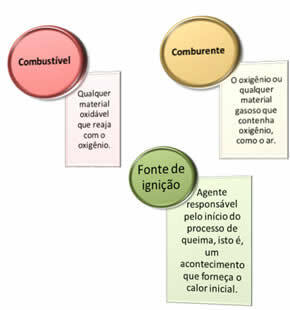
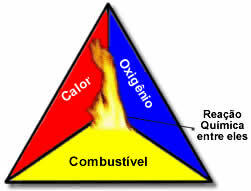
Estos tres factores componen el triángulo de fuego, porque una vez que comienza la reacción de combustión, la energía liberada sostiene la reacción y permite que continúe hasta que el combustible, oxidante o calor (energía liberada) desaparezca. Esto significa que habrá un reacción en cadena.
Por ejemplo, si alguien arroja un cigarrillo encendido en un bosque, se producirá un incendio (reacción de combustión). En este caso, el arbusto es el combustible
, O oxígeno presente en el aire atmosférico es el oxidante es el cigarrillo iluminado era el fuente de ignición. Esta quema continuará hasta que se elimine uno de los tres factores. Si los bomberos arrojan agua, se eliminará el calor. Pero incluso si no se hace nada para detener esta quema, terminará en algún momento, es decir, cuando se acabe el combustible (bosque).Como ya se mencionó, en estas reacciones se libera calor, por lo que la combustión es una reacción exotérmica. Sin embargo, este tipo de reacción es una combustión incompleta. Para entender por qué, vea la diferencia entre combustión completa e incompleta:
Combustión completa:
Analizando los compuestos orgánicos como combustibles, tenemos que:
| LOS combustión completa Ocurrirá cuando la cadena de carbono se rompa y todos los átomos de carbono en la cadena de carbono estén completamente oxidados. |
| usted productos formados por hidrocarburos será el CO2 (dióxido de carbono) y H2O (Agua). |
Observe la combustión completa del isooctano, que es uno de los componentes de la gasolina.
C8H18 (g) +25/2 O2 (g) → 8 CO2 (g) + 9 horas2O(1)
combustión incompleta
| En este caso, no hay suficiente oxidante, es decir, suficiente oxígeno para quemar todo el combustible. |
| Por tanto, los productos formados son CO (monóxido de carbono) y H2O. |
Observe la misma combustión de isoctano, sin embargo, ahora de forma incompleta:
C8H18 (g) + 17/2 O2(gramo) → 8 CO (gramo) + 9 horas2O(1)
La quema de bosques es un ejemplo, ya que las emisiones resultantes consisten en CO y materias particulares, como hollín (C), así como cenizas y otros compuestos orgánicos simples y complejos. También se pueden formar óxido de nitrógeno, ozono y aldehídos como resultado de reacciones secundarias debido a la presencia de otros componentes en el aire.
C8H18 (g) + 9/2 O2 (g) → 8C (gramo) + 9 horas2O(1)
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm