Oxidación es el nombre que se le da al proceso de pérdida de electrones por un átomo, grupo o especie iónica durante un reacción química. Se identifica por el aumento de NOX (número de oxidación) de la especie o átomo al comparar reactivo y producto.
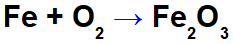
Ecuación de oxidación del hierro.
En la ecuación anterior, por ejemplo, podemos indicar los NOX de cada uno de los participantes:
Hierro reactivo (Fe): tiene NOX 0 ya que es un sustancia simple;
Oxígeno en el reactivo (O): tiene NOX 0 por ser una sustancia simple;
Oxígeno en el producto: tiene NOX -2 porque no está ligado a un metal alcalino, tierra alcalina o formación de hidrógeno peróxidos o superóxidos;
Hierro en el producto: tiene NOX +3 porque la suma del NOX del hierro multiplicado por 2 (número de átomos) + NOX del oxígeno multiplicado por 3 debe dar como resultado 0 ya que es una sustancia compuesta:
x.2 + 3. (- 2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Comparando el NOX del reactivo hierro (0) con el producto (+3), observamos un aumento, es decir, se sometió al proceso de
oxidación. Vale la pena señalar que la aparición de oxidación siempre va acompañado del fenómeno de reducción (que significa ganancia de electrones), identificado por la disminución de NOx, como ocurre con el oxígeno en el ejemplo.Lea también:Determinación del número de oxidación (NOX)
Ejemplos de situaciones en las que se produce la oxidación:
1. Combustión

La combustión de un material también es indicativa de oxidación.
Combustión es toda reacción química que se produce en presencia de un combustible cualquiera y el gas oxígeno oxidante (O2), lo que resulta en la producción de calor y luz. En cada reacción de combustión ocurre oxidación.
2. Algunas reacciones orgánicas
En cada reacción orgánica que tiene lugar en presencia de los medios enumerados a continuación, el proceso de oxidación:
Dicromato de potasio (K2Cr2O7) o permanganato de potasio (KMnO4);
Presencia de ácido fuerte o base fuerte;
Gas de ozono (O3) en presencia de zinc metálico (Zn) y agua (H2O).
3. Pilas o pilas

Las baterías son dispositivos en los que siempre se produce la oxidación.
Pilas o las baterías son dispositivos electroquímicos que almacenan sustancias químicas. Una de estas sustancias se oxidará y la otra se reducirá, lo que dará como resultado la producción de corriente eléctrica.
4. Electrólisis
Electrólisis es un proceso químico en el que una solución acuosa que contiene una sal se somete a una corriente eléctrica, que acaba favoreciendo la oxidación de los aniones presentes en estos materiales. En toda electrólisis, hay oxidación.
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm
