Las moléculas de las sustancias no son todas rectas, como si estuvieran en un solo plano. Después de todo, están dispersos en el espacio y sus átomos adoptan diferentes disposiciones o arreglos. Así, existen diferentes formas geométricas para las moléculas de cada tipo de sustancia.
Una de las formas más sencillas de determinar la geometría de una molécula se basa en la teoría de repulsión de pares de electrones de capa de valencia (RPECV). Según esta teoría, los pares de electrones del átomo central funcionan como nubes electronicas que se repelen. De esta manera, se orientan lo más lejos posible entre sí. La geometría molecular dependerá del número de pares electrónicos alrededor del átomo central.
Esta nube electrónica puede estar compuesta por electrones que participan en enlaces (simples, dobles o triples) y también que no participan. Entonces tenemos:
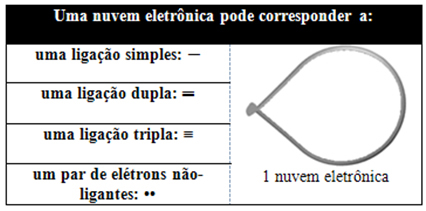
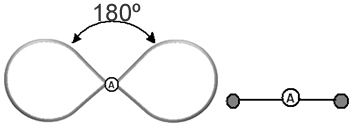
Es útil pensar en esta nube como un globo o globos atados, con el átomo central en el centro de ellos. Por ejemplo, en una molécula que tiene solo dos nubes de electrones alrededor del átomo central, el mayor La distancia posible entre ellos es un ángulo de 180º y, en consecuencia, la geometría de la molécula será lineal.
Por tanto, podemos hacer una deducción sobre cómo será la geometría molecular de la mayoría de las moléculas si tenemos en cuenta la número de átomos en las moléculas, y los enlaces que hace el átomo central, verificando si tiene o no pares de electrones.
Vea los ejemplos a continuación:
- Moléculas con 2 átomos: siempre será lineal
Por ejemplo:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- Molécula de 3 átomos: angular o triangular
si el átomo central poseer un par de electrones no vinculantes la geometría será angular, como en el caso de la molécula de SO2:
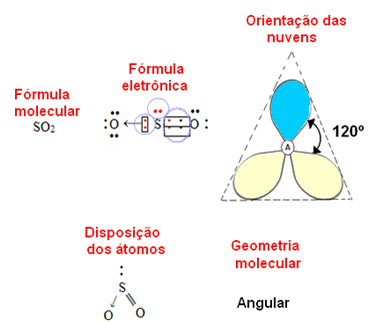
Considere la nube de electrones azul para representar pares de electrones que no participan en los enlaces, y la amarilla como pares de electrones que participan en los enlaces.
- Molécula de 4 átomos: plano trigonal (o triangular) o piramidal (o pirámide trigonal)
Si el átomo central no tiene un par de electrones no apareados (sin enlace), la geometría molecular es trigonal plana (o triangular). Mira el ejemplo de BF3:

Si el átomo tiene pares de electrones no vinculantes, la geometría de la molécula será piramidal (o pirámide trigonal), como en el caso del amoníaco:

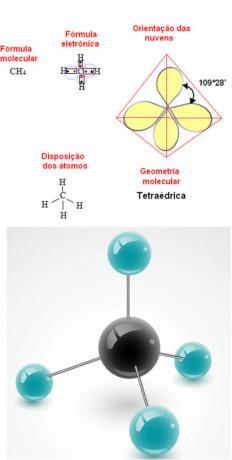
- Molécula de 5 átomos: tetraédrico
Ejemplo de geometría de metano:
- Molécula con 6 átomos: bipirámide trigonal o pirámide triangular.
Un ejemplo es el pentacloruro de fósforo (PCl5), que tiene unas conexiones entre fósforo y cloro en un ángulo de 90º y otras de 120º, formando una bipirámide de base triangular:
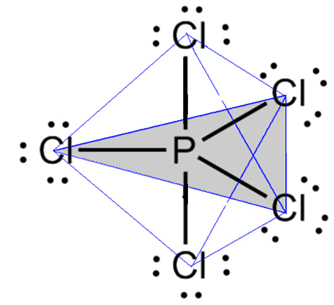
- Molécula de 7 átomos: octaédrico
Ejemplo: hexafluoruro de azufre (SF6), cuyos ángulos son de 90º.

Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm

