Las diferentes sustancias que existen en el universo están compuestas por átomos, iones o moléculas. Los elementos químicos se combinan a través de enlaces químicos. Estos enlaces pueden ser:
| Enlace covalente | enlace iónico | Conexión de metal |
|---|---|---|
intercambio de electrones |
transferencia de electrones |
Entre átomos de metal |
Utilice las preguntas a continuación para poner a prueba su conocimiento de los enlaces químicos.
Ejercicios propuestos
Pregunta 1
Para interpretar las propiedades de diferentes sustancias, es necesario conocer los enlaces entre los átomos y los enlaces entre las moléculas respectivas. En relación al enlace entre átomos se puede decir que ...
(A) entre átomos enlazados predominan las fuerzas de atracción.
(B) cuando se forma un enlace entre átomos, el sistema formado alcanza la energía máxima.
(C) las atracciones y repulsiones en una molécula no son solo de naturaleza electrostática.
(D) entre los átomos ligados existe un equilibrio entre las atracciones y repulsiones electrostáticas.
Alternativa correcta: (D) Entre los átomos ligados existe un equilibrio entre las atracciones y repulsiones electrostáticas.
Los átomos están formados por cargas eléctricas y son las fuerzas eléctricas entre las partículas las que conducen a la formación de enlaces. Por lo tanto, todos los enlaces químicos son de naturaleza electrostática.
Los átomos tienen fuerzas de:
- repulsión entre núcleos (cargas positivas);
- repulsión entre electrones (cargas negativas);
- atracción entre núcleos y electrones (cargas positivas y negativas).
En todos los sistemas químicos, los átomos buscan volverse más estables y esta estabilidad se logra en un enlace químico.
La estabilidad se debe al equilibrio entre las fuerzas de atracción y repulsión, ya que los átomos alcanzan un estado de menor energía.
Pregunta 2
Haga coincidir correctamente las oraciones en la columna I y el tipo de vínculo en la columna II.
| I | II |
|---|---|
| (A) Entre átomos de Na | 1. enlace covalente simple |
| (B) Entre átomos de Cl | 2. enlace covalente doble |
| (C) Entre átomos de O | 3. Conexión de metal |
| (D) Entre N átomos | 4. enlace iónico |
| (E) Entre átomos de Na y Cl | 5. triple enlace covalente |
Respuesta:
Átomos |
Tipos de conexión |
Representación |
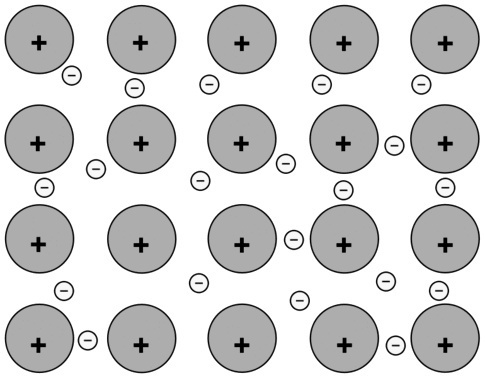
(A) Entre átomos de Na |
Conexión metálica. Los átomos de este metal están unidos entre sí mediante enlaces metálicos y la interacción entre cargas positivas y negativas aumenta la estabilidad del conjunto. |
 |
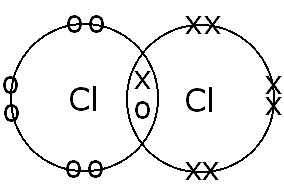
(B) Entre átomos de Cl |
Enlace covalente simple. El intercambio de electrones y la formación de enlaces simples ocurren porque solo hay un par de electrones de enlace. |
 |
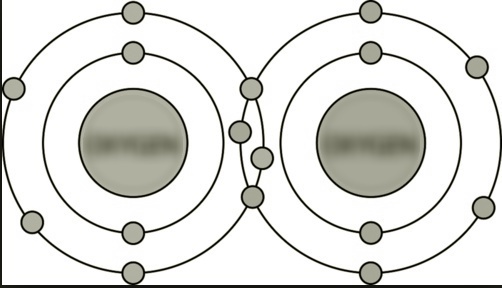
(C) Entre átomos de O |
Enlace covalente doble. Hay dos pares de electrones de enlace. |
 |
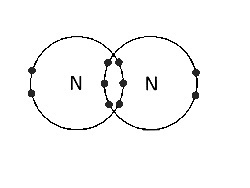
(D) Entre N átomos |
Enlace triple covalente. Hay tres pares de electrones de enlace. |
 |
(E) Entre átomos de Na y Cl |
Enlace iónico. Establecido entre iones positivos (cationes) e iones negativos (aniones) mediante transferencia de electrones. |
 |
Pregunta 3
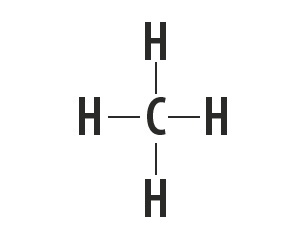
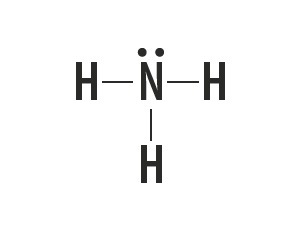
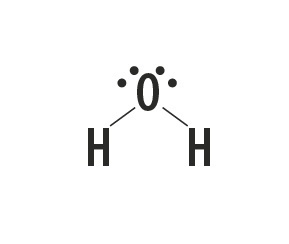
El metano, el amoniaco, el agua y el fluoruro de hidrógeno son sustancias moleculares cuyas estructuras de Lewis están representadas en la siguiente tabla.
| Metano, CH4 | Amoníaco, NH3 | Agua, H2O | fluoruro de hidrógeno, HF |
|---|---|---|---|
 |
 |
 |
 |
Indica el tipo de enlace que se establece entre los átomos que componen estas moléculas.
Respuesta correcta: enlace covalente simple.
Mirando la tabla periódica, vemos que los elementos de las sustancias no son metales.
El tipo de enlace que estos elementos forman entre ellos es el enlace covalente, ya que comparten electrones.
Los átomos de carbono, nitrógeno, oxígeno y flúor forman ocho electrones en la capa de valencia debido a la cantidad de enlaces que forman. Luego obedecen la regla del octeto.
El hidrógeno, por otro lado, participa en la formación de sustancias moleculares al compartir un par de electrones, estableciendo enlaces covalentes simples.
vea también: Enlaces químicos
preguntas del examen de ingreso
Las preguntas sobre los enlaces químicos aparecen con frecuencia en los exámenes de ingreso a la universidad. Vea a continuación cómo se puede abordar el tema.
Pregunta 1
(UEMG) Las propiedades que presenta un determinado material pueden explicarse por el tipo de enlace químico presente entre sus unidades formadoras. En un análisis de laboratorio, un químico identificó las siguientes propiedades para cierto material:
- Alta temperatura de fusión y ebullición.
- Buena conductividad eléctrica en solución acuosa.
- Mal conductor de la electricidad de estado sólido
De las propiedades que muestra este material, marque la alternativa que indica el tipo de conexión predominante en él:
(A) metálico
(B) covalente
(C) dipolo inducido
(D) iónico
Alternativa correcta: (D) iónico.
Un material sólido tiene altas temperaturas de fusión y ebullición, es decir, necesitaría mucha energía para cambiar a un estado líquido o gaseoso.
En estado sólido, el material es un mal conductor de la electricidad debido a la organización de los átomos que forman una geometría bien definida.
En contacto con el agua, aparecen iones, formando cationes y aniones, facilitando el paso de la corriente eléctrica.
El tipo de enlace que hace que el material tenga estas propiedades es el enlace iónico.
Pregunta 2
(PUC-SP) Analice las propiedades físicas en la siguiente tabla:
| Muestra | Punto de fusión | Punto de ebullición | Conductividad eléctrica a 25 ° C | Conductividad eléctrica a 1000 ° C |
|---|---|---|---|---|
| LA | 801 ° C | 1413 ° C | aislante | conductor |
| B | 43 ° C | 182 ° C | aislante | |
| C | 1535 ° C | 2760 ° C | conductor | conductor |
| D | 1248 ° C | 2250 ° C | aislante | aislante |
Según los modelos de enlace químico, A, B, C y D se pueden clasificar, respectivamente, como,
(A) compuesto iónico, metal, sustancia molecular, metal.
(B) metal, compuesto iónico, compuesto iónico, sustancia molecular.
(C) compuesto iónico, sustancia molecular, metal, metal.
(D) sustancia molecular, compuesto iónico, compuesto iónico, metal.
(E) compuesto iónico, sustancia molecular, metal, compuesto iónico.
Alternativa correcta: (E) compuesto iónico, sustancia molecular, metal, compuesto iónico.
Analizando los estados físicos de las muestras cuando se someten a las temperaturas presentadas, tenemos que:
| Muestra | Estado físico a 25 ° C | Estado físico a 1000 ° C | Clasificación de compuestos |
| LA | sólido | líquido | Iónico |
| B | sólido | Molecular | |
| C | sólido | sólido | Metal |
| D | sólido | sólido | Iónico |
Ambos compuestos A y D son aislantes en estado sólido (a 25 ° C), pero cuando la muestra A cambia a estado líquido, se vuelve conductora. Estas son las características de los compuestos iónicos.
Los compuestos iónicos de estado sólido no permiten la conductividad debido a la forma en que los átomos se organizan.
En solución, los compuestos iónicos se convierten en iones y permiten que se conduzca la electricidad.
Es característico de los metales que tengan buena conductividad como la muestra C.
Los compuestos moleculares son eléctricamente neutros, es decir, aislantes como la muestra B.
vea también: Eslabones metálicos
Pregunta 3
(Fuvest) Considere el elemento cloro que forma compuestos con, respectivamente, hidrógeno, carbono, sodio y calcio. ¿Con cuál de estos elementos forma el cloro compuestos covalentes?
Respuesta:
| Elementos | Cómo ocurre la llamada | enlace formado | |
| cloro | Hidrógeno | 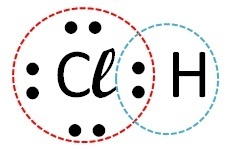 |
Covalente (intercambio de electrones) |
| cloro | Carbón | 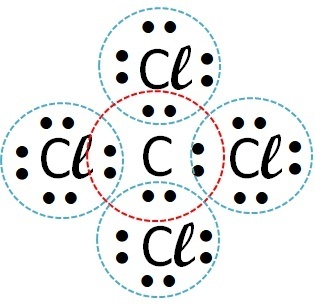 |
Covalente (intercambio de electrones) |
| cloro | Sodio |  |
Iónico (transferencia de electrones) |
| cloro | Calcio | 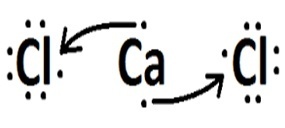 |
Iónico (transferencia de electrones) |
Los compuestos covalentes ocurren en la interacción de átomos no metálicos, no metales con hidrógeno o entre dos átomos de hidrógeno.
Entonces el enlace covalente ocurre con cloro + hidrógeno y cloro + carbono.
El sodio y el calcio son metales y se unen al cloro a través de un enlace iónico.
Preguntas enem
El enfoque de Enem sobre el tema puede ser un poco diferente de lo que hemos visto hasta ahora. Vea cómo aparecieron los enlaces químicos en la prueba de 2018 y aprenda un poco más sobre este contenido.
Pregunta 1
(Enem / 2018) La investigación muestra que los nanodispositivos basados en movimientos atómicos-dimensionales, inducidos por ligero, puede tener aplicaciones en tecnologías futuras, reemplazando micromotores, sin necesidad de componentes mecánica. Un ejemplo de movimiento molecular inducido por la luz se puede ver doblando una oblea de silicio delgada, unido a un polímero de azobenceno y un material de soporte, en dos longitudes de onda, como se ilustra en figura. Con la aplicación de luz, ocurren reacciones reversibles de la cadena del polímero, que promueven el movimiento observado.
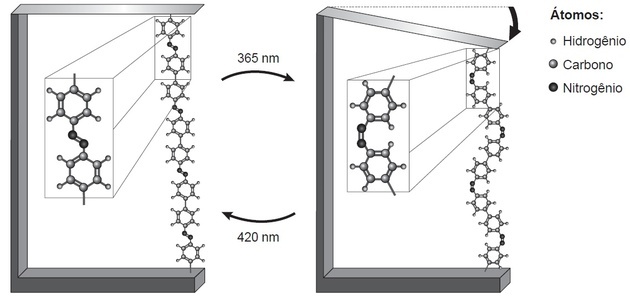
TOMAR, H. Y. Nanotecnología de moléculas. Nueva química en la escuela, n. 21 de mayo de 2005 (adaptado).
El fenómeno del movimiento molecular, promovido por la incidencia de la luz, surge de (a)
(A) movimiento vibratorio de los átomos, que conduce al acortamiento y relajación de los enlaces.
(B) isomerización de enlaces N = N, siendo la forma cis del polímero más compacta que la trans.
(C) tautomerización de las unidades monoméricas del polímero, que conduce a un compuesto más compacto.
(D) resonancia entre los electrones π del grupo azo y los del anillo aromático que acortan los dobles enlaces.
(E) variación conformacional de enlaces N = N que da como resultado estructuras con diferentes áreas de superficie.
Alternativa correcta: (B) isomerización de enlaces N = N, siendo la forma cis del polímero más compacta que la trans.
El movimiento en la cadena del polímero hace que se observe un polímero más largo a la izquierda y uno más corto a la derecha.
Con la parte de polímero resaltada, observamos dos cosas:
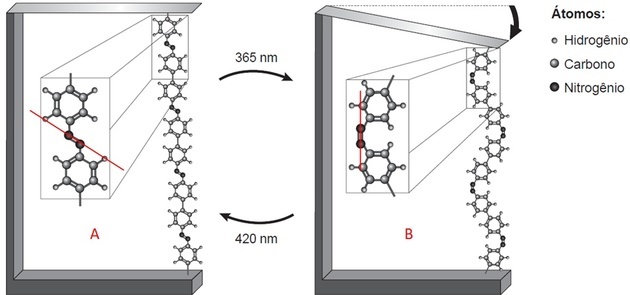
- Hay dos estructuras que están unidas por un enlace entre dos átomos (que la leyenda indica que es nitrógeno);
- Este enlace está en diferentes posiciones en cada imagen.
Trazando una línea sobre la imagen, en A observamos que las estructuras están por encima y por debajo del eje, es decir, lados opuestos. En B, están en el mismo lado de la línea trazada.
El nitrógeno hace que tres enlaces sean estables. Si está unido a la estructura por un enlace, entonces está unido al otro nitrógeno a través de un doble enlace covalente.
La compactación del polímero y la flexión de la hoja se producen porque los aglutinantes están en diferentes posiciones cuando se produce la isomería de los enlaces N = N.
Se observa isomería trans en A (enlazadores en lados opuestos) y cis en B (enlazadores en el mismo plano).
Pregunta 2
(Enem / 2018) Algunos materiales sólidos están compuestos por átomos que interactúan entre sí formando enlaces que pueden ser covalentes, iónicos o metálicos. La figura muestra la energía potencial de unión en función de la distancia interatómica en un sólido cristalino. Analizando esta figura, se observa que, a temperatura de cero kelvin, la distancia de equilibrio del enlace entre los átomos (R0) corresponde al valor mínimo de energía potencial. Por encima de esa temperatura, la energía térmica suministrada a los átomos aumenta su energía cinética y provoca oscilan alrededor de una posición de equilibrio promedio (círculos rellenos), que es diferente para cada temperatura. La distancia de conexión puede variar en toda la longitud de las líneas horizontales, identificadas con el valor de temperatura de T1 La t4 (aumento de temperatura).

El desplazamiento observado en la distancia media revela el fenómeno de
(A) ionización.
(B) dilatación.
(C) disociación.
(D) ruptura de enlaces covalentes.
(E) formación de enlaces metálicos.
Alternativa correcta: (B) dilatación.
Los átomos tienen cargas positivas y negativas. Los enlaces se forman cuando alcanzan una energía mínima al equilibrar las fuerzas (repulsión y atracción) entre átomos.
De esto entendemos que: para que se produzca un enlace químico existe una distancia ideal entre los átomos para que sean estables.
El gráfico que se muestra nos muestra que:
- La distancia entre dos átomos (interatómico) disminuye hasta alcanzar un mínimo de energía.
- La energía puede aumentar cuando los átomos se acercan tanto que las cargas positivas en sus núcleos se acercan, comienzan a repelerse entre sí y, en consecuencia, aumentan la energía.
- A temperatura T0 de cero Kelvin es el valor mínimo de energía potencial.
- Hay un aumento en la temperatura de T1 a T4 y la energía suministrada hace que los átomos oscilen alrededor de la posición de equilibrio (círculos llenos).
- La oscilación se produce entre la curva y el círculo completo correspondiente a cada temperatura.
A medida que la temperatura mide el grado de agitación de las moléculas, cuanto mayor es la temperatura, más oscila el átomo y aumenta el espacio ocupado por él.
La temperatura más alta (T4) indica que habrá un mayor espacio ocupado por ese grupo de átomos y así, el material se expande.
Pregunta 3
(Enem / 2019) Porque tienen una capa de valencia completa, alta energía de ionización y afinidad electrónica prácticamente nulo, se consideró durante mucho tiempo que los gases nobles no formarían compuestos productos químicos. Sin embargo, en 1962 se llevó a cabo con éxito la reacción entre el xenón (capa de valencia 5s²5p⁶) y el hexafluoruro de platino y, desde entonces, se han sintetizado más compuestos de gases nobles nuevos.
Tales compuestos demuestran que no se puede aceptar acríticamente la regla del octeto, en la que se considera que, en un enlace químico, los átomos tienden a adquirir estabilidad asumiendo la configuración electrónica de gas noble. Entre los compuestos conocidos, uno de los más estables es el difluoruro de xenón, en el que dos átomos de halógeno El flúor (capa de valencia 2s²2p⁵) se une covalentemente al átomo de gas noble para tener ocho electrones de valencia.
Al escribir la fórmula de Lewis para el compuesto de xenón mencionado anteriormente, ¿cuántos electrones hay en la capa de valencia del átomo de gas noble?
(A) 6
(B) 8
(C) 10
(D) 12
Alternativa correcta: c) 10.
El flúor es un elemento que forma parte del grupo 17 de la tabla periódica. Por lo tanto, en su capa electrónica más externa hay 7 electrones (2s2 2p5). Para adquirir estabilidad, según la regla del octeto, el átomo de este elemento necesita un electrón para tener así 8 electrones en la capa de valencia y asumir la configuración electrónica de un gas noble.
El xenón, en cambio, es un gas noble y, por tanto, ya tiene 8 electrones en la última capa (5s2 5p6).
Tenga en cuenta que el nombre del compuesto es difluoruro de xenón, es decir, el compuesto está formado por dos átomos de flúor y un átomo de xenón, XeF2.
Como dice el enunciado, el enlace químico entre átomos es de tipo covalente, es decir, se comparten electrones.
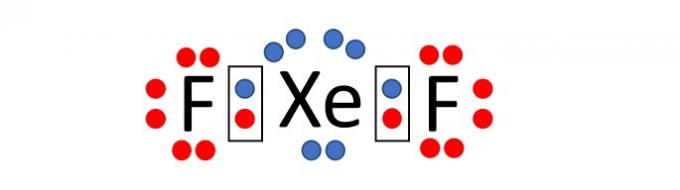
Distribuyendo los electrones alrededor de cada átomo (7 alrededor del flúor y 8 alrededor del xenón) vemos que el átomo de xenón, cuando se une con dos átomos de flúor, tiene 10 electrones en la capa de flúor. valencia.
vea también:
- Regla del octeto
- Ejercicios de distribución electrónica
- Ejercicios sobre hidrocarburos

