En el texto "¿Cómo funcionan las sustancias catalizadoras?”, Se ha demostrado que los catalizadores son capaces de aumentar la velocidad de las reacciones porque disminuyen la energía de activación necesaria para que se produzca la reacción. Lo hacen cambiando el mecanismo de reacción, combinándose con los reactivos y formando un compuesto intermedio, que a su vez se convierte en los productos y el catalizador.
Una de las formas para que esto suceda se llama Catálisis homogénea, que es cuando el catalizador forma un sistema monofásico con los reactivos.
Esto significa que los reactivos, productos y catalizador deben estar todos en la misma fase, es decir, en el mismo estado físico.
El estudio de este tipo de catálisis es importante para la ciencia y la industria, ya que varias reacciones importantes para la producción pueden acelerarse con pequeñas cantidades de catalizadores.
Un ejemplo de catálisis homogénea utilizada en la industria es un paso intermedio en la fabricación de ácido sulfúrico (H
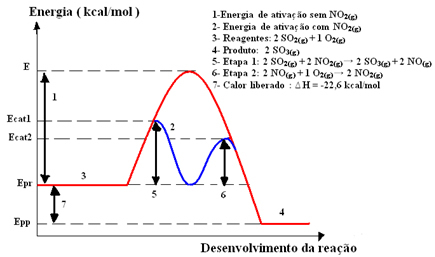
2SOLO4 (aq)), en el que la formación de trióxido de azufre (SO3 (g)) a través de la reacción de combustión del dióxido de azufre (SO2 (g)), mostrado a continuación:2 ASÍ2 (g) + O2 (g) → 2 SO3 (g)
Esta reacción avanza demasiado lentamente, por lo que se agrega un catalizador, dióxido de nitrógeno (NO).2 (g)). Este catalizador se combina con dióxido de azufre para formar un compuesto intermedio (complejo activado), que es monóxido de nitrógeno (NO(gramo)).
Este compuesto intermedio luego reacciona con oxígeno gaseoso (O2 (g)) para la regeneración del catalizador. Vea a continuación cómo ocurre esto y observe cómo están todos en fase gaseosa, formando un medio homogéneo:
Catalizadorcomplejo activado
Paso 1: 2 SO2 (g) + 2 NO2 (g)→ 2 SO3 (g) + 2 NO(gramo)
Paso 2: 2 NO(gramo)+ 1 O2 (g) → 2 NO2 (g)
Reacción global: 2 SO2 (g) + O2 (g) → 2 SO3 (g)
Tenga en cuenta que el catalizador solo participa en los pasos intermedios, pero no se consume. Al final de la reacción, está completamente recuperado. La reacción con este mecanismo realizada en dos pasos requiere que ocurra menos energía de activación y, por lo tanto, avanza más rápidamente.
Representación gráfica:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm
