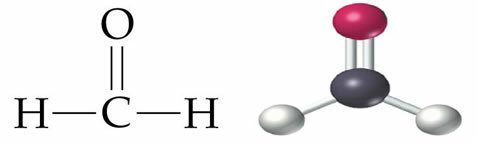La isomería química es un fenómeno que se observa cuando dos o más sustancias orgánicas tienen la misma fórmula molecular, pero diferente estructura molecular y propiedades.
Las sustancias químicas con estas características se denominan isómeros.
El término se deriva de las palabras griegas iso = igual y mero = partes, es decir, partes iguales.
Existen diferentes tipos de isomería:
- isómero plano: Los compuestos se identifican mediante fórmulas estructurales planas. Se divide en isomería de cadena, isomería de función, isomería de posición, isomería de compensación e isomería de tautomería.
- isómero espacial: La estructura molecular de los compuestos tiene diferentes estructuras espaciales. Se divide en isomería geométrica y óptica.
isómero plano
A isomería plana o isomería constitucional, la estructura molecular de las sustancias orgánicas es plana.
Los compuestos que presentan esta característica se denominan isómeros planos.
isómero de cadena
La isomería de cadena ocurre cuando los átomos de carbono tienen diferentes cadenas y la misma función química.
Ejemplos:
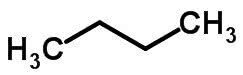
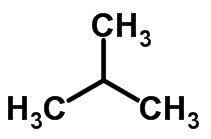
Isomería de función
La isomería de función ocurre cuando dos o más compuestos tienen diferentes funciones químicas y la misma fórmula molecular.
Ejemplos: este caso es común entre aldehídos y cetonas.
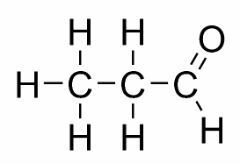
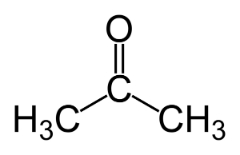
Isómero de posición
La isomería de posición ocurre cuando los compuestos se diferencian por diferentes posiciones de insaturación, ramificación o grupos funcionales en la cadena de carbono. En este caso, los isómeros tienen la misma función química.
Ejemplos:

isómero compensador
La isomería o metamerismo de compensación ocurre en compuestos con la misma función química que se diferencian por la posición de los heteroátomos.
Ejemplos:

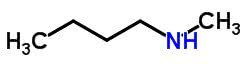
Tautomery
La tautomería o isomería dinámica puede considerarse un caso específico de isomería de función. En este caso, un isómero puede transformarse en otro cambiando la posición de un elemento en la cadena.
Ejemplos:

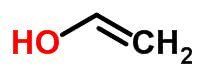
isómero espacial
LA isomería espacial, también llamado estereoisomería, ocurre cuando dos compuestos tienen la misma fórmula molecular y diferentes fórmulas estructurales.
En este tipo de isomería, los átomos se distribuyen de la misma forma, pero ocupan diferentes posiciones en el espacio.
isómero geométrico
LA isomería geométrica o cis-trans ocurre en cadenas abiertas insaturadas y también en compuestos cíclicos. Para hacer esto, los ligandos de carbono deben ser diferentes.

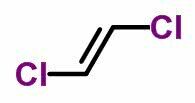
- Cuando los mismos ligandos están en el mismo lado, la nomenclatura del isómero recibe el prefijo cis.
- Cuando los mismos ligandos están en lados opuestos, la nomenclatura recibe el prefijo trans.
La IUPAC (Unión Internacional de Química Pura y Aplicada) recomienda que en lugar de cis y trans, se utilicen las letras Z y E como prefijo.
Esto se debe a que Z es la primera letra de la palabra alemana zusammen, que significa "juntos". Y es la primera letra de la palabra alemana entegegen, que significa "opuesto".
isómero óptico
LA isomería óptica se demuestra por compuestos que son ópticamente activos. Ocurre cuando una sustancia es causada por la desviación angular en el plano de la luz polarizada.
- Cuando una sustancia dobla la luz óptica hacia la derecha, se llama diestro.
- Cuando una sustancia dobla la luz óptica hacia la izquierda, la sustancia se llama levorotario.
Una sustancia también puede existir en dos formas ópticamente activas, dextogyra y levogyra. En este caso, se llama enantiómero.
Para que un compuesto de carbono sea ópticamente activo, debe ser quiral. Esto significa que sus ligandos no pueden superponerse, siendo asimétricos.
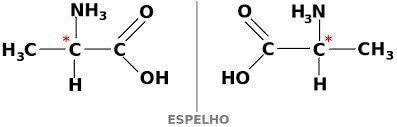
A su vez, si un compuesto tiene las formas dextrogyra y levorotary en partes iguales, se denominan mezclas racémicas. La actividad óptica de las mezclas racémicas está inactiva.
Lea también:
- Carbón
- Química Orgánica
- Fórmula molecular
- fórmula estructural
Ejercicios
1. (Mackenzie 2012) Número de la columna B, que contiene compuestos orgánicos, asociándolos con la columna A, según el tipo de isomería que presenta cada molécula orgánica.
Columna A
1. isómero compensador
2. isómero geométrico
3. isómero de cadena
4. isómero óptico
Columna B
() ciclopropano
() etoxi-etano
() bromo-cloro-fluoro-metano
() 1,2-dicloro-eteno
La secuencia correcta de números en la columna B, de arriba a abajo, es
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternativa b) 3 - 1 - 4 - 2.
2. (Uerj) Isomery es el fenómeno que se caracteriza por el hecho de que una misma fórmula molecular representa estructuras diferentes.
Considerando la isomería estructural plana para la fórmula molecular C4H8, podemos identificar isómeros de los siguientes tipos:
a) cadena y posición
b) cadena y función
c) función y compensación
d) cargo y compensación
Alternativa a) cuerda y posición
3. (OSEC) La propanona y el isopropenol ejemplifican un caso de isomería:
a) de metameria
b) de función
c) de tautomery
d) cis-tran
e) cadena
Alternativa c) de tautomery
vea también: Ejercicios de isomería plana