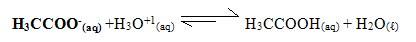Algunos metales no se encuentran libres en la naturaleza y deben obtenerse mediante procedimientos de laboratorio. Uno de los métodos efectivos y económicos de purificar metales es a través de la electrólisis. La electrólisis tiene lugar en celdas electrolíticas, con dos electrodos conectados a los terminales de un generador de corriente continua.
Se sabe que en una celda electrolítica hay un cátodo y un ánodo, consulte la definición de cada uno:
Cátodo: Es el electrodo negativo el que atrae a los cationes, y aquí es donde ocurre la reducción de cationes.
ánodo: El electrodo positivo que atrae los aniones y, por tanto, aquí es donde se oxida el anión.
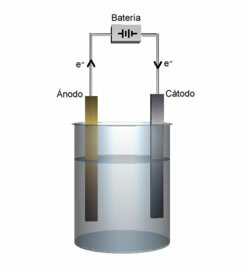
Demostración de ánodo y cátodo.
Purificación de cobre
El cobre tal como se encuentra en la naturaleza tiene impurezas como plata, hierro, oro, zinc. Mediante electrólisis es posible aislar este metal obteniéndolo en forma pura, siga el proceso:
- El cobre impuro funciona como ánodo y una solución acuosa de sulfato de cobre funciona como electrolito, que se encuentra dentro de la celda electrolítica. El cátodo de la célula es el propio cobre con un alto grado de pureza.
- El cobre se transfiere del ánodo al cátodo mientras las impurezas permanecen en solución. El cobre en su estado puro se acumula en el cátodo y, por lo tanto, puede usarse.
Por Líria Alves
Licenciada en Química
Equipo Escolar de Brasil
¡Vea mas!
Reacciones de electrólisis
Productos de electrólisis
Electrólisis - Fisicoquímica - Química - Escuela Brasil
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/purificacao-metais-atraves-eletrolise.htm