La tabla periódica es una importante herramienta de estudio que recopila información sobre todos los elementos químicos conocidos.
Pon a prueba tus conocimientos con esta lista de 17 preguntas con los diferentes enfoques sobre el tema y resuelve tus dudas con las resoluciones comentadas tras la retroalimentación.
Para ayudar a comprender las preguntas, utilice el tabla periodica completa y actualizada.
Organización de la tabla periódica
Pregunta 1
(UFU) A principios del siglo XIX, con el descubrimiento y aislamiento de varios elementos químicos, se hizo necesario clasificarlos racionalmente, para poder realizar estudios sistemáticos. Se fueron sumando muchos aportes hasta llegar a la actual clasificación periódica de elementos químicos. Respecto a la clasificación periódica actual, responda:
a) ¿Cómo se enumeran secuencialmente los elementos en la tabla periódica?
La tabla periódica está organizada en secuencias de elementos químicos en orden ascendente de número atómico. Este número corresponde al número de protones en el núcleo del átomo.
Este método de organización fue propuesto por Henry Moseley cuando reconfiguró la mesa propuesta por Dmitri Mendeleiev.
Un elemento se puede ubicar en la tabla por familia y período en el que se inserta. Esta distribución ocurre de la siguiente manera:
| grupos o familias | 18 secuencias verticales |
| Grupos de elementos que tienen características similares. |
| Periodos | 7 secuencias horizontales |
| Número de capas electrónicas que tiene el elemento. |
b) ¿Qué grupos de la tabla periódica se pueden encontrar: un halógeno, un metal alcalino, un metal alcalinotérreo, un calcógeno y un gas noble?
La clasificación de elementos en grupos se realiza según propiedades. Los elementos que están en un mismo grupo tienen características similares y para las clasificaciones dadas tenemos que:
| Clasificación | Grupo | Familia | Elementos |
| halógeno | 17 | 7A | F, Cl, Br, I, At y Ts |
| metal alcalino | 1 | 1A | Li, Na, K, Rb, Cs y Fr |
| metal alcalinotérreo | 2 | 2A | Be, Mg, Ca, Sr, Ba y Ra |
| calcógeno | 16 | 6A | O, S, Se, Te, Po y Lv |
| gas noble | 18 | 8A | Él, Ne, Ar, Kr, Xe, Rn y Og |
Pregunta 2
(PUC-SP) Resuelva el problema con base en el análisis de las declaraciones a continuación.
I - La tabla periódica moderna actual está organizada en orden ascendente de masa atómica.
II - Todos los elementos que tienen 1 electrón y 2 electrones en la capa de valencia son, respectivamente, metales alcalinos y metales alcalinotérreos, siempre que el número cuántico principal de esta capa (n 1).
III - En el mismo período, los elementos presentan el mismo número de niveles (capas).
IV - En un mismo grupo (familia), los elementos tienen el mismo número de niveles (capas).
Se concluye que, con respecto a la tabla periódica actual de elementos químicos, son correctos:
a) I y IV (solo).
b) I y II (solo).
c) II y III (solo).
d) II y IV (solo).
e) III y IV (solo).
Alternativa correcta: c) II y III (solo).
Analizando cada alternativa tenemos que:
YO - INCORRECTO. Los elementos están dispuestos en orden ascendente de número atómico.
II - CORRECTO. Los electrones en la capa de valencia definen el grupo en el que se encuentra el elemento.
| Metales alcalinos | 1 electrón en la capa de valencia |
| 3leer | 2-1 |
| 11A | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87P. | 2-8-18-32-18-8-1 |
| metales alcalinotérreos | 2 electrones en la capa de valencia |
| 4ser | 2-2 |
| 12mg | 2-8-2 |
| 20Aquí | 2-8-8-2 |
| 38Señor | 2-8-18-8-2 |
| 56Licenciado en Letras | 2-8-18-18-8-2 |
| 88Rana | 2-8-18-32-18-8-2 |
El número cuántico principal corresponde a la capa en la que se encuentra el electrón, siendo diferente de 1 porque por la distribución electrónica notamos que la ubicación del electrón es de la segunda capa o n = 2.
III - CORRECTO. La ubicación de un elemento en un período determinado se debe al número de capas al realizar la distribución electrónica.
| Periodos | 7 secuencias horizontales |
| 1 ° período | 1 capa: K |
| 2do período | 2 capas: K, L |
| 3er periodo | 3 capas: K, L, M |
| Cuarto período | 4 capas: K, L, M, N |
| 5to período | 5 capas: K, L, M, N, O |
| Sexto período | 6 capas: K, L, M, N, O, P |
| Séptimo período | 7 capas: K, L, M, N, O, P, Q |
Ejemplo: elemento químico ubicado en el segundo período.
IV - INCORRECTO. Los elementos que pertenecen a un mismo grupo tienen características similares y esto se debe al hecho de que tienen el mismo número de electrones en la capa de valencia.
Ejemplo:
| Berilio | Magnesio |
|
2 electrones en capa de valencia. |
2 electrones en capa de valencia. |
Por tanto, el berilio y el magnesio forman parte del grupo 2 de la tabla periódica.
Pregunta 3
(Unitins) Con respecto a la clasificación periódica moderna de elementos, identifique el enunciado verdadero:
a) en una familia, los elementos generalmente tienen el mismo número de electrones en la última capa.
b) en la tabla periódica, los elementos químicos se colocan en orden descendente de masas atómicas.
c) en una familia, los elementos tienen propiedades químicas muy diferentes.
d) en un período, los elementos tienen propiedades químicas similares.
e) todos los elementos representativos pertenecen al grupo B de la tabla periódica.
Alternativa correcta: a) en una familia, los elementos generalmente tienen el mismo número de electrones en la última capa.
a) CORRECTO. Los elementos químicos de la misma familia tienen el mismo número de electrones en la última capa y esto hace que tengan características similares.
b) INCORRECTO. Las masas atómicas aumentan a medida que aumenta el número atómico del elemento.
c) INCORRECTO. Las propiedades químicas de los elementos son similares, por lo que se agrupan en la misma familia.
d) INCORRECTO. Al mismo tiempo, los elementos tienen sus electrones distribuidos en el mismo número de capas.
e) INCORRECTO. Los elementos representativos pertenecen al grupo A, que corresponde a las familias: 1A, 2A, 3A, 4A, 5A, 6A, 7A y 8A. Los elementos que pertenecen al grupo B son elementos de transición.
pregunta 4
(Vunesp) Considerando las propiedades de los elementos químicos y la tabla periódica, es incorrecto afirmar:
a) un metal es una sustancia conductora de corriente eléctrica, es dúctil y maleable.
b) un no metálico es una sustancia que no conduce corriente eléctrica, no es dúctil ni maleable.
c) un semimetal tiene la apariencia física de un metal, pero un comportamiento químico similar al de un no metal.
d) la mayoría de los elementos químicos están compuestos por no metales.
e) los gases nobles son monoatómicos.
Alternativa incorrecta: d) la mayoría de los elementos químicos son no metales.
Tenga en cuenta la clasificación de los elementos químicos en la tabla periódica en metales, no metales y semimetales.

Como podemos ver, la mayoría de los elementos son metales.
a) CORRECTO. Los metales conducen la electricidad debido a las nubes de electrones formadas por electrones libres, que son característicos de su estructura. Son dúctiles porque pueden convertirse en alambres o láminas, dependiendo de la región donde se aplique la presión. También son maleables, ya que se pueden producir láminas muy finas con este tipo de material.
b) CORRECTO. Los no metales tienen características opuestas a los metales. En lugar de conductores, son buenos aislantes térmicos y, como son frágiles, no se moldean en alambres o láminas, ya que no tienen buena ductilidad y maleabilidad.
c) CORRECTO. Los semimetales tienen características intermedias a los metales y no metales. Al ser semiconductores de electricidad, tienen un brillo metálico pero son frágiles como los no metales.
d) INCORRECTO. La mayoría de los elementos se clasifican como metales. Las clases de metales presentes en la tabla periódica son: alcalinos, alcalinotérreos, transicionales internos y externos.
e) CORRECTO. Los gases nobles son monoatómicos, por lo que están representados solo por sus iniciales.
Ejemplo:
| gas noble | calcógeno |
| Helio (él) | Oxígeno (O2) |
| monoatómico: formado por un átomo | diatómico: formado por dos átomos |
Debido a la estabilidad de los gases nobles, los elementos de esta familia tienen baja reactividad y también se conocen como inertes.
pregunta 5
Sobre la organización de la tabla periódica actual, responda:
a) ¿Qué son las columnas?
b) ¿Qué son las líneas?
c) ¿Cuál es el método utilizado para organizar los elementos químicos?
Respuestas:
a) las columnas son los grupos de la Tabla Periódica, antes llamados familias, que reúnen elementos químicos con propiedades similares.
b) Las líneas son los períodos de la tabla periódica e indican el número de capas electrónicas de un átomo en el estado fundamental.
c) Los elementos químicos de la tabla periódica actual están ordenados en orden ascendente de número atómico, lo que indica el número de protones en el núcleo del átomo.
Familias de la tabla periódica
Pregunta 1
(CESGRANRIO) Haciendo la asociación entre las columnas a continuación, que corresponden a las familias de elementos según la tabla periódica, la secuencia numérica será:
| 1. Gases nobles | • Grupo 1A |
| 2. Metales alcalinos | • Grupo 2A |
| 3. metales alcalinotérreos | • Grupo 6A |
| 4. Calcógenos | • Grupo 7A |
| 5. Halógenos | • Grupo 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Alternativa correcta: b) 2, 3, 4, 5, 1.
| grupos | Configuración electrónica |
| • Grupo 1A: 2. Metales alcalinos | nosotros1 (con n |
| • Grupo 2A: 3. metales alcalinotérreos | nosotros2 (con n |
| • Grupo 6A: 4. Calcógenos | nosotros2notario público4 |
| • Grupo 7A: 5. Halógenos | nosotros2notario público5 |
| • Grupo 0: 1. Gases nobles | 1 s2 (El) o nosotros2notario público6 (si n> 1) |
Pregunta 2
(UECE) El elemento químico con Z = 54 tiene en su capa de valencia la configuración 5s2 5p6. Los elementos con Z = 52 y con Z = 56 pertenecen a las familias de:
a) calcógenos y alcalinotérreos
b) halógenos y álcalis
c) halógenos y alcalinotérreos
d) calcógenos y álcalis
Alternativa correcta: a) calcógenos y alcalinotérreos.
Dados los números atómicos, realizamos la distribución electrónica y encontramos los siguientes resultados:
| 54X y | 52Tú | 56Licenciado en Letras |
|
8 electrones en capa de valencia |
6 electrones en capa de valencia |
2 electrones en capa de valencia |
| Gases nobles: familia 8A | Calcógenos: familia 6A | Tierra alcalina: familia 2A |
Pregunta 3
(F. Ibero-Americana-SP) El grupo de la Tabla Periódica que se caracteriza por el predominio de elementos artificiales es el siguiente:
a) lantánidos
b) gases nobles
c) metales de transición
d) metales alcalinotérreos
e) actínidos
Alternativa correcta: e) actínidos.
Los elementos artificiales son aquellos que no existen en la naturaleza y que han sido sintetizados en el laboratorio mediante reacciones nucleares.
También se denominan elementos transuránicos, ya que estos elementos radiactivos tienen un número atómico superior a 92, que corresponde al uranio.
En general, estos elementos son de corta duración, hasta fracciones de segundo.
Según esta información tenemos que:
Los elementos que se encuentran en la naturaleza son: lantánidos, gases nobles, metales de transición y metales alcalinotérreos. Con la excepción del tecnecio y el prometio, que son artificiales.
El predominio de elementos artificiales son los actínidos, clasificados como metales de transición internos e insertados en la tabla periódica debajo de los lantánidos. De esa serie, solo actinio, torio, protactinio y uranio son naturales.
pregunta 4
(U. Iglesia Católica de Salvador-BA) La especie X2- con 8 electrones en la capa más externa (capa de valencia) puede ser del elemento X, que, en la tabla periódica, pertenece al grupo:
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Alternativa correcta: b) 6A.
Según la regla del octeto, para que un elemento adquiera estabilidad, asume la configuración electrónica de un gas noble, que tiene 8 electrones en la capa de valencia.
Carga 2- sobre la especie X2- indica que el elemento ha ganado 2 electrones.
La configuración electrónica de la especie que tiene 8 electrones en la capa más externa es ns2notario público6.
Al perder dos electrones, el elemento vuelve a su estado fundamental con una configuración de electrones ns.2notario público4.
Los 6 electrones de la capa de valencia son característicos de los calcógenos, elementos de la familia 6A.
Por ejemplo:
| Elemento: oxígeno | Configuración electrónica |
| 8O | 1 s22 s22p4 |
| especie O2- | 1 s22 s22p6 |
Aprender más sobre Familias de la tabla periódica.
Elementos químicos
Pregunta 1
(CESGRANRIO) Dados los elementos de números atómicos 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 y 75, la opción que solo contiene metales alcalinos es:
a) 3, 11, 37 y 55
b) 3, 9, 37 y 55
c) 9, 11, 38 y 55
d) 12, 20, 38 y 56
e) 12, 37, 47 y 75
Alternativa correcta: a) 3, 11, 37 y 55
Los metales alcalinos corresponden a los elementos químicos que terminan la distribución electrónica con un electrón en el subnivel s.
Haciendo la distribución electrónica de los números atómicos dados, tenemos los siguientes metales alcalinos:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Litio | Sodio | Rubidio | Cesio |
Los otros números atómicos corresponden a elementos de los siguientes grupos:
Metales alcalinotérreos: terminar la distribución electrónica en el subnivel s2.
| Z = 12 | Z = 38 | Z = 56 |
| Magnesio | Estroncio | Bario |
Metales de transición: terminar la distribución electrónica en el subnivel d.
| Z = 30 | Z = 47 | Z = 75 |
| Zinc | Plata | Renio |
Halógenos: terminar la distribución electrónica en el subnivel p5.
| Z = 9 |
Pregunta 2
(Unirio) “El corazón artificial colocado en Eloi se empezó a desarrollar hace cuatro años en Estados Unidos y ya lo utilizan unas 500 personas. El conjunto, llamado Heartmate, se compone de tres piezas principales. La más importante es una bolsa redonda de cuatro libras, 12 centímetros de diámetro y 3 centímetros de grosor, hecha de titanio, un metal blanco plateado, ligero y resistente ". Revista Veja, julio de 1999.
Entre los metales de abajo, el que tiene, en la última capa, un número de electrones igual al del titanio es:
a) C
b) En
c) Ga
d) Mg
exe
Alternativa correcta: d) Mg.
| Titanio | Configuración electrónica | Distribución de capas |
| 22Tú | 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
De la distribución electrónica del titanio, vemos que este elemento tiene 2 electrones en la última capa.
| Elemento | Configuración electrónica | Distribución de capas |
| 6C | 1 s2 2 s2 2p2 | 2, 4 |
| 11A | 1 s2 2 s2 2p6 3 s1 | 2, 8, 1 |
| 31Georgia | 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1 s2 2 s2 2p6 3 s2 | 2, 8, 2 |
| 54X y | 1 s2 2 s2 2p6 3 s2 3p6 3d10 4s2 4p6 4d10 5 s2 5p6 | 2, 8, 18, 18, 8 |
El elemento que también tiene 2 electrones en la última capa es el magnesio.
Pregunta 3
(UFPA) Considere un determinado elemento químico cuyo subnivel más energético es 5s2. Su número atómico y el grupo en el que se ubica en la Tabla Periódica son, respectivamente:
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Alternativa correcta: c) 38; 2A
Al hacer la distribución electrónica, encontramos que:
- El elemento químico se encuentra en la familia. 2A, ya que tiene el subnivel más energético el s2
- Tiene número atómico 38, que corresponde al número total de electrones distribuidos.
- Se ubica en el quinto período, ya que la distribución electrónica se realizó hasta la quinta capa.
Verificando esta información en la Tabla Periódica, podemos confirmar que se trata del elemento estroncio.
pregunta 4
(UFC) Un átomo de x tiene un protón más que un átomo de y. Con base en esta información, determine la declaración correcta.
a) Si y es alcalinotérreo, x es un metal alcalino.
b) Si y es un gas noble, x es un halógeno.
c) Si y es un metal de transición, x es un gas noble.
d) Si y es un gas noble, x es un metal alcalino.
e) x se encuentra en el mismo período antes del átomo y en la tabla periódica.
Alternativa correcta: d) Si y es un gas noble, x es un metal alcalino.
La tabla periódica está organizada en orden ascendente de número atómico.
Si Y tiene un número atómico z y X tiene un protón más que él, significa que estos dos elementos están en el mismo período y X es posterior a Y.
Ejemplo:
| Elemento | elemento subsiguiente |
| zY | z + 1X |
| 11A | 12mg |
Los dos elementos están en el tercer período y el magnesio tiene un protón más que el sodio.
Según este razonamiento tenemos que:
un error. Un metal alcalino se antepone a un metal alcalinotérreo en la tabla periódica. La afirmación correcta sería: si y es un metal alcalino, x es alcalinotérreo.
b) INCORRECTO. Un halógeno viene antes del gas noble en la tabla periódica. La afirmación correcta sería: si y es halógeno, x es gas noble.
c) INCORRECTO. Los metales de transición y los gases nobles están separados por otros elementos químicos y, por lo tanto, no son secuenciales.
d) CORRECTO. Los gases nobles son el último grupo de la tabla periódica y los metales alcalinos el primero, por lo que son secuenciales.
Ejemplo:
| gas noble | metal alcalino |
| zY | z + 1X |
| 2él | 3leer |
El litio, un metal alcalino, tiene un protón más que el helio, que es un gas noble.
e) INCORRECTO. X está en el mismo período que Y solo después de él, no antes como los estados alternativos.
pregunta 5
A partir del número atómico de un elemento químico es posible saber:
a) el número de neutrones en el núcleo
b) el número de electrones en la electrosfera
c) la masa del núcleo
Respuesta: b) la cantidad de electrones en la electrosfera
Un átomo en el estado fundamental es eléctricamente neutro. Entonces, conociendo el número atómico, que corresponde al número de protones (partículas cargadas positivamente), conocemos el número de electrones (partículas cargadas negativamente) en la electrosfera.
Por ejemplo, el hierro tiene un número atómico 26, por lo que en el estado fundamental tiene 26 electrones alrededor del núcleo.
Aprender más sobre elementos químicos es el número atómico.
Propiedades periódicas y aperiódicas
Pregunta 1
(UFSM) Juzgar si las declaraciones relacionadas con las propiedades periódicas de los elementos son verdaderas (V) o falsas (F).
() Depende de las masas atómicas de los elementos.
() Se repiten a intervalos más o menos regulares en relación al aumento de los números atómicos.
() Son similares en el mismo grupo de elementos.
() Son similares en el mismo período de elementos.
() En el mismo grupo, los valores numéricos de las propiedades periódicas siempre aumentan cuando hay un aumento en el número atómico de elementos.
La secuencia correcta es:
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Alternativa correcta: c) F - V - V - F - F
(FALSO) Dependen de las masas atómicas de los elementos.
Según la ley de periodicidad de Moseley, muchas propiedades físicas y químicas de los elementos químicos varían según el número atómico.
(CIERTO) Se repiten a intervalos más o menos regulares en relación con el aumento de los números atómicos.
Propiedades como radio atómico, volumen atómico, densidad, punto de fusión y ebullición son ejemplos de propiedades que se repiten regularmente en la tabla periódica.
(CIERTO) Son similares en el mismo grupo de elementos.
Los grupos de la tabla periódica se han organizado con elementos que tienen propiedades similares.
(FALSO) Son similares en el mismo período de elementos.
Las propiedades son similares en familias, no en períodos. En períodos, los elementos se distribuyen por el número de capas electrónicas.
(FALSO) En el mismo grupo, los valores numéricos de las propiedades periódicas siempre aumentan cuando hay un aumento en el número atómico de elementos.
Las propiedades pueden aumentar o disminuir según el número atómico. Un ejemplo de esto es la electronegatividad, que disminuye a medida que aumenta el número atómico en un grupo dado.
Lea también: Propiedades periódicas
Pregunta 2
(FAESP) Las propiedades aperiódicas de los elementos son:
a) densidad, volumen atómico y masa atómica.
b) punto de fusión, electronegatividad y calor específico.
c) volumen atómico, masa atómica y punto de fusión.
d) masa atómica, calor específico y punto de fusión.
e) masa atómica y calor específico.
Alternativa correcta: e) masa atómica y calor específico.
Las propiedades aperiódicas se repiten a intervalos regulares.
La masa atómica es la medida del peso del átomo en unidades de masa atómica, que corresponde a de la masa de carbono-12.
El calor específico determina la cantidad de calor necesaria para aumentar la temperatura en 1 ° C de 1 g del elemento.
Estas dos propiedades no están relacionadas con la posición del elemento en la tabla periódica.
Las otras propiedades se clasifican como periódicas a medida que aumentan o disminuyen con el número atómico. Son ellas:
- Densidad: representa el cociente entre la masa y el volumen de un elemento.
- Volumen atómico: representa el volumen de un conjunto de átomos e influye en la distancia entre ellos.
- Punto de fusión: temperatura a la que se produce la transición de sólido a líquido.
- Electronegatividad: la capacidad del átomo de atraer hacia sí el par electrónico que comparte en un enlace covalente.
Lea también: electronegatividad y Afinidad electrónica
Pregunta 3
(PUC-PR) Entre los siguientes diagramas relacionados con la tabla periódica, ¿cuáles son los correctos?
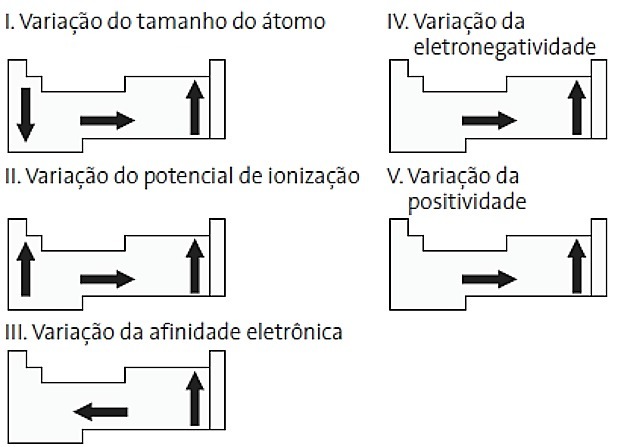
a) II y V
b) II y III
c) I y V
d) II y IV
e) III y IV
Alternativa correcta: d) II y IV.
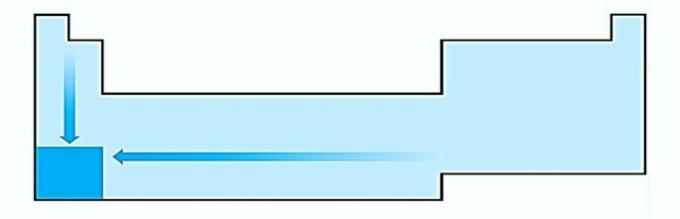
I. EQUIVOCADO. La variación del tamaño del átomo se mide por la distancia promedio desde el núcleo hasta el electrón más externo. Los átomos más grandes se encuentran en la parte inferior de la tabla, por lo que el aumento se produce según el número atómico y la representación correcta es:
II. CORRECTO La energía necesaria para arrancar un electrón de un átomo aislado en estado gaseoso se denomina potencial de ionización. Aumenta como se muestra en el diagrama de declaraciones.
III. EQUIVOCADO. La afinidad electrónica expresa la energía liberada cuando un átomo neutro en estado gaseoso recibe un electrón, que es una propiedad muy importante de los no metales. Las mayores afinidades electrónicas se observan en halógenos y oxígeno.
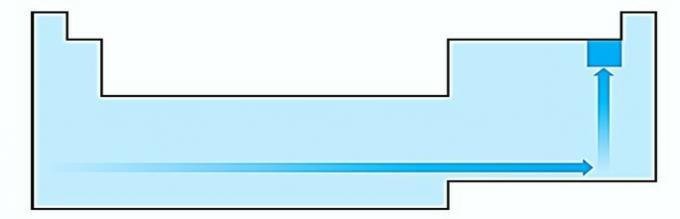
IV. CORRECTO La electronegatividad está relacionada con el potencial de ionización y la afinidad electrónica. Como tales, los halógenos son los elementos más electronegativos de la tabla periódica.
V. EQUIVOCADO. La electropositividad ocurre en la dirección opuesta a la electronegatividad. Representa la capacidad del átomo para ceder electrones.
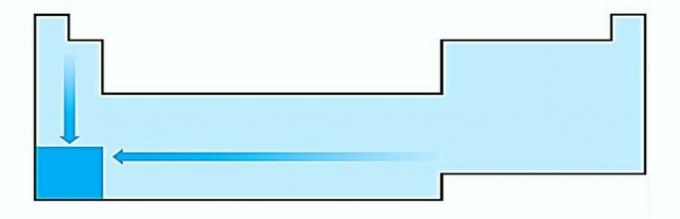
Por lo tanto, los metales alcalinos tienen la mayor electropositividad.
Siga probando sus conocimientos con las listas:
- Ejercicios sobre enlaces químicos.
- Ejercicios de distribución electrónica
- Ejercicios sobre modelos atómicos
- Ejercicios de termoquímica

