Las sales son sustancias químicas formadas por enlaces iónicos entre átomos. La función de la sal inorgánica corresponde a compuestos iónicos que tienen al menos un catión distinto al H+ y un anión distinto del OH-.
Las sales están presentes en nuestro día a día, siendo muy utilizadas en la alimentación y también en otros ámbitos. Ellos son ejemplos de sales:
- Cloruro de sodio (NaCl): conocido popularmente como sal de mesa
- Carbonato de calcio (CaCO3): presente en mármoles y calizas
- Sulfato de calcio (CaSO4): forma yeso y tiza escolar
- Bicarbonato de sodio (NaHCO3): utilizado en cocina, medicina y como agente de limpieza
Estas sustancias generalmente se forman en una reacción neutralizante, cuando un ácido y una base reaccionan para producir una sal y agua.
HCl(ácido) + NaOH (base) → NaCl(sal) + H2O(Agua)
En esta reacción, los reactivos ácido clorhídrico (HCl) e hidróxido de sodio (NaOH) forman los productos cloruro de sodio (NaCl) y agua (H2O).
En el enlace iónico se produce la transferencia de electrones entre átomos y para ello uno de los átomos debe ser metálico y el otro no metálico. Con esto, las especies químicas positivas, los cationes, se forman al donar electrones y los aniones cargados negativamente, que los recibieron.
Observe en la imagen de abajo cómo se forma el cloruro de sodio (NaCl).
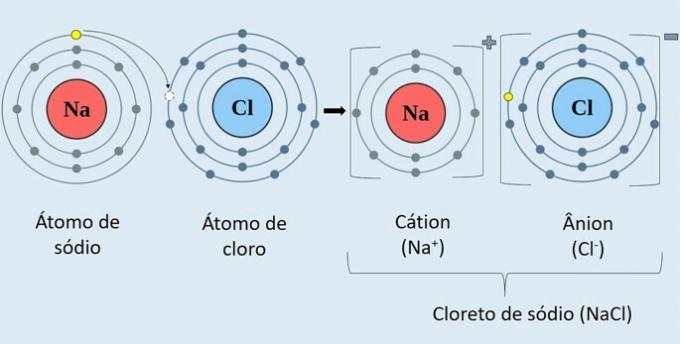
El átomo de sodio metálico (Na) dona un electrón al átomo de cloro (Cl). Por lo tanto, se forma el catión Na+, que consiste en el ion sodio positivo y el anión Cl-, que corresponde al ion cloro negativo.
conocer más sobre ácidos y bases.
Características de las sales
Es importante tener en cuenta que, en solución acuosa, los ácidos siempre liberan catión H+ y las bases liberan el anión OH- (concepto de Arrhenius).
Las sales, sin embargo, no siempre tienen el mismo catión o anión y, por esta razón, no muestran propiedades funcionales bien definidas. Sin embargo, podemos decir que en general:
- Son compuestos iónicos (formados por grupos de iones y no moléculas);
- Muchos tienen un sabor salado característico (casi siempre venenoso);
- Son sólidos y cristalinos;
- Conducir corriente eléctrica en solución;
- Se derriten y hierven a altas temperaturas;
- Soluble en agua (excepciones: algunos sulfuros; los cloruros, bromuros y yoduros con los cationes Ag+, hg22+ y Pb2+, entre otros).
También lea sobre funciones quimicas.
Clasificación y nomenclatura de sales.
De acuerdo con la forma en que ocurre la reacción de formación de sal, se clasifican en tres tipos:
Sales neutras o normales
Reacción de neutralización total (todos los H reaccionan+ de ácido y todo OH- de la base). Estas sales cuando se disuelven en agua no cambian el pH.
Ejemplos de:
NaOH (base) + HCl (ácido) → NaCl (sal normal) + H2O
3NaOH (base) + H3POLVO4 (ácido) → Na3POLVO4 (sal normal) + 3H2O
Nombre de las sales normales: el nombre de la sal proviene del nombre del anión ácido, cuya terminación _hídrico o _oso o _ico será reemplazado respectivamente por: _etho ou_ito o _act y el catión base.
Sal = (nombre del anión) + sufijo etho / ito / acten (nombre del catión).
Así:
- ácido clorohídrico (HCl) + hidróxido de sodio (NaOH) → cloroethosodio (NaCl) + agua
- ácido nitratohueso(HNO2) + hidróxido de potasio(KOH) → nitratomuy de potasio(KNO2) + agua
- ácido ortofosforadoich (2h3POLVO4) + hidróxido de calcio(3Ca (OH)2 → ortofosfoactuar de calcio [Aquí3(POLVO4)2] + agua (6H2O)
Sales ácidas o sales de hidrógeno
Reacción de neutralización ácida parcial (cuando no todos los H+ del ácido reaccionan, por lo que la sal tiene en su estructura uno o más hidrógenos ionizables del ácido).
Ejemplo:
NaOH (base) + H2SOLO4 (ácido) → NaHSO4 (sal ácida) + H2O
Nombre de las sales ácidas: similar a las sales normales, pero con indicación del número de H+ por prefijos mono, di, trietc.
Sal = prefijo del número H+ + (nombre del anión) + sufijo etho / ito / acten (nombre del catión).
ácido azufreich (H2SOLO4) + hidróxido de sodio(NaOH) → monohidrógenoazufreactuaren sodio (NaHSO4) + agua
ácido ortofosforadoich (H3POLVO4) + hidróxido sodio(NaOH) → dihidrógeno-ortofosfoactuar sodio (NaH2POLVO4) + agua
Sales básicas o hidroxi sales
Reacción de neutralización de base parcial (si no reaccionan todos los hidroxilos, la sal tiene uno o más hidroxilos en su estructura).
Ejemplo:
Ca (OH)2 (base) + HCl (ácido) → Ca (OH) Cl (sal básica) + H2O
Nombre de las sales básicas: similar a las sales normales, pero indicando el número de OH- en su estructura.
Sal = prefijo numérico OH- + (nombre del anión) + sufijo etho / ito / acten (nombre del catión).
ácido clorohídrico (HCl) + hidróxido de calcio [Ca (OH)2] → monohidroxicloroetho de calcio [Ca (OH) Cl] + agua
ácido clorohídrico (2HCl) + hidróxido aluminio [Al (OH)3] → monohidroxicloroethoen aluminio [Al (OH) Cl2] + agua
Sales dobles o mixtas
Reacción de una di, tri o tetrabase con diferentes bases (doble sal para el catión) o de una di, tri o tetrabase con diferentes ácidos (doble sal para el anión).
Ejemplos de:
En cuanto al catión:
H2SOLO4 (diácido) + KOH (base) + NaOH (base) → KNaSO4 (doble sulfato de potasio y sodio) + 2H2O
H3POLVO4 (triácido) + 2KOH (base) + NaOH (base) → K2NaPO4 (ortofosfato monosódico dipotásico)
En cuanto al anión:
Ca (OH)2 (dibasa) + HBr (ácido) + HCl (ácido) → CaBrCl (cloruro de calcio-bromuro) + 2H2O
Al (OH)3 (tribasa) + H2SOLO4(ácido) + HCl (ácido) → Al (SO4) Cl (cloruro de aluminio sulfato) + 3H2O
Conozca los principales funciones inorgánicas y asegúrese de revisar las preguntas del examen de ingreso sobre el tema, con resolución comentada, en: ejercicios sobre funciones inorgánicas.

