El monóxido de carbono es un gas incoloro, inodoro, inflamable y tóxico.
Su fórmula molecular es CO. Consiste en una molécula de carbono y oxígeno.
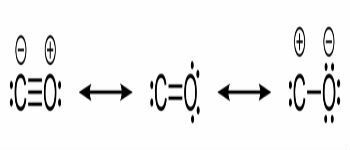
Fórmulas estructurales de monóxido de carbono y enlaces químicos entre carbono y oxígeno.
Se origina de dos formas:
- Fuentes de transmisión naturales: actividad de volcanes, gas natural y descargas eléctricas.
- actividades humanas: resultado de combustión combustibles fósiles incompletos. La quema produce toneladas de CO, siendo una de las principales actividades que liberan CO a la atmósfera.
Características
El monóxido de carbono pertenece al grupo de óxidos. Se clasifica como óxido neutro, los formados por un metal más oxígeno. Además, no reacciona con agua, ácidos y bases.
Se utiliza como agente reductor, elimina el oxígeno de un compuesto y produce el dióxido de carbono (CO2). Por tanto, su uso en el procesamiento de minerales, como el hierro, es muy común. Así como en la producción de sustancias orgánicas, como ácido acético, plásticos, metanol, entre otros.
Al reaccionar con el oxígeno del aire, produce dióxido de carbono. Según la siguiente reacción química: 2 CO + O2 → 2 CO2
En aguas superficiales, la alta concentración de monóxido de carbono sirve como fuente de energía para los microorganismos.
El monóxido de carbono es uno de los gases de efecto invernadero. Su concentración en la atmósfera contribuye a una mayor retención de calor. Por tanto, se considera un gas contaminante.
Intoxicación
El CO tiene una gran afinidad por la hemoglobina. Al ser tóxico, su inhalación produce efectos en la salud humana e incluso puede provocar la muerte.
Debido a que el CO no tiene olor, es posible que se inhale sin que se note. Por eso, en algunos casos, la persona tarda mucho en notar la intoxicación.
Cuando se inhala a baja concentración, causa migrañas, pensamiento lento, irritación ocular y pérdida de la capacidad manual. En concentraciones elevadas puede provocar convulsiones, pérdida del conocimiento e incluso la muerte por asfixia.
Pero, ¿cómo ocurre la intoxicación?
LA hemoglobina conecta, por supuesto, a la O2 y lo transporta a los tejidos corporales. Sin embargo, la afinidad entre el CO y la hemoglobina es mucho mayor, unas 250 veces más que con el O2.
En presencia de CO, la hemoglobina se une a él, impidiendo el transporte de oxígeno a las células. La combinación de CO con hemoglobina da lugar a carboxihemoglobina.
Las principales causas de intoxicación por CO ocurren en las siguientes situaciones:
- Motores de automóviles que funcionan en interiores;
- Quema de gas natural en calentadores ineficientes;
- Salida de gas de cocina u horno de leña, en áreas mal ventiladas.
En países con un clima frío, las casas tienden a permanecer cerradas por más tiempo y utilizan sistemas de calefacción. Para evitar accidentes por gas, los detectores de CO se utilizan cada vez más.
Obtenga más información, lea también:
- Ciclo del carbono
- Carbón
- Combustibles fósiles
- Oxígeno


