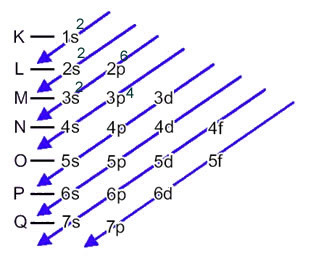
La distribución electrónica de los electrones de un átomo en el estado neutro o fundamental se realiza comúnmente con el Diagrama de Pauling, mostrado a continuación:
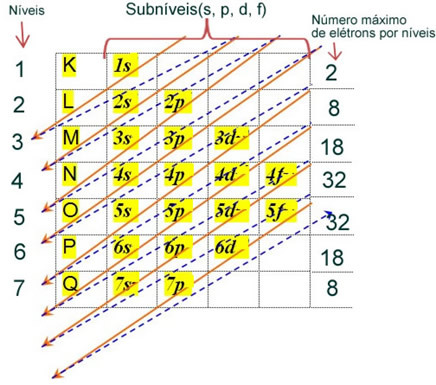
Las reglas detalladas de esta distribución se pueden encontrar en los dos textos siguientes en nuestro sitio web: “Distribución electrónica de electrones" y "Reglas de distribución electrónica”.
La distribución electrónica de iones funciona inicialmente de la misma manera que para los átomos en estado neutro; con una sola diferencia. Dado que un ion es un átomo que ha ganado o perdido electrones, debemos tener esto en cuenta y hacer lo siguiente:

Una observación importante es: el cambio se realiza en el subnivel más externo y no en el más enérgico.
si el ion es un catión, debemos quitar los electrones que perdió. Veamos un ejemplo:
El átomo de hierro (número atómico = 26) tiene la siguiente distribución electrónica en los subniveles en orden energético: 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d6. En cuanto a las capas electrónicas, tenemos: K =2; L = 8; M = 14; N = 2.
Esta distribución se muestra en el diagrama de Pauling a continuación:
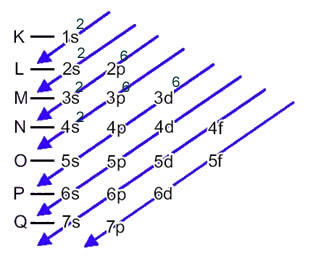
Cuando el átomo de hierro pierde 2 electrones, se convierte en el catión Fe.2+. Entonces, al realizar su distribución electrónica tenemos que eliminar 2 electrones de la última capa(N) y no del subnivel más energético, Como se muestra abajo:
No pares ahora... Hay más después de la publicidad;)
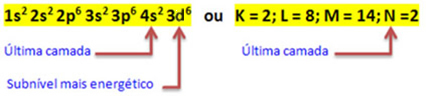
Por tanto, la distribución electrónica del catión Fe2+ es dado por:
1 s2 2 s2 2p6 3 s2 3p6 3d6 o K = 2; L = 8; M = 14
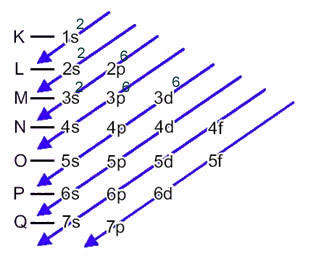
Ahora bien, si tenemos que realizar la distribución electrónica de un anión, debemos suma los electrones que recibió.Vea cómo se hace esto en el siguiente ejemplo:
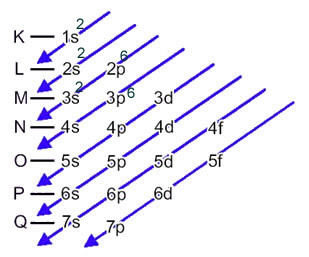
El anión de azufre (16s2-) se forma a partir del átomo de azufre (16S) por la ganancia de 2 electrones, como lo indica la carga 2-. Su distribución electrónica de estado fundamental viene dada por:
1 s2 2 s2 2p6 3 s2 3p4 o K = 2; L = 8; M = 6
En este caso, el último subnivel es el mismo que el subnivel de energía, 3p. Entonces, le agregamos los dos electrones del anión azufre:
1 s2 2 s2 2p6 3 s2 3p6 o K = 2; L = 8; M = 8
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Distribución electrónica de iones"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm. Consultado el 27 de junio de 2021.
