Las propiedades periódicas de los elementos químicos son las características que tienen.
Tenga en cuenta que los elementos químicos de la tabla periódica tienen una ubicación específica que varía según las propiedades periódicas que exhiben. Están clasificados en orden ascendente de número atómico.
Según la ley de Moseley:
“Muchas propiedades físicas y químicas de los elementos varían periódicamente en la secuencia de los números atómicos de los elementos..”
Principales propiedades periódicas
radio atómico
Relacionada con el tamaño de los átomos, esta propiedad se define por la distancia entre los centros de los núcleos de dos átomos del mismo elemento.
Por lo tanto, los rayo atómico corresponde a la mitad de la distancia entre los núcleos de dos átomos vecinos, expresándose de la siguiente manera:
r = d / 2
Dónde:
r: relámpago
D: distancia internuclear
Se mide en picómetros (pm). Esta medida es un submúltiplo del medidor:
1 pm = 10-12 metro
En la tabla periódica, el radio atómico aumenta de arriba hacia abajo en la posición vertical. En la horizontal, aumentan de derecha a izquierda.
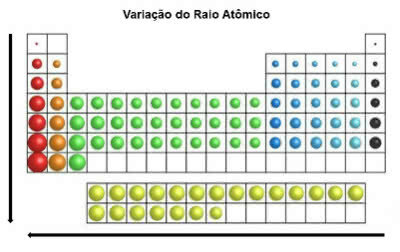
Variación del radio atómico
El elemento químico que tiene el radio atómico más grande es el cesio (Cs).
Volumen atómico
Esta propiedad periódica indica el volumen ocupado por 1 mol del elemento en estado sólido.
Vale la pena señalar que el volumen atómico no es el volumen de 1 átomo, sino un conjunto de 6.02. 1023 átomos (valor de 1 mol)
El volumen atómico de un átomo se define no solo por el volumen de cada átomo, sino también por el espacio que existe entre esos átomos.
En la tabla periódica, los valores del volumen atómico aumentan de arriba hacia abajo (vertical) y del centro al borde (horizontal).

Variación del volumen atómico
Para calcular el volumen atómico se utiliza la siguiente fórmula:
V = m / d
Dónde:
V: volumen atómico
metro: masa de 6.02. 1023 átomos de elementos
D: densidad de elementos de estado sólido
Densidad absoluta
LA densidad La absoluta, también llamada "masa específica", es una propiedad periódica que determina la relación entre la masa (m) de una sustancia y el volumen (v) ocupado por esa masa.
Se calcula mediante la siguiente fórmula:
d = m / v
Dónde:
D: densidad
metro: pasta
v: volumen
En la tabla periódica, los valores de densidad aumentan de arriba hacia abajo (vertical) y de los bordes al centro (horizontal).
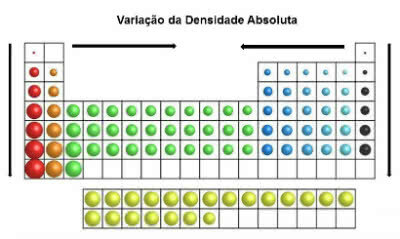
Variación de densidad absoluta
Así, los elementos más densos están en el centro y en la parte inferior de la tabla:
Osmio (Os): d = 22,5 g / cm3
Iridio (Ir): d = 22,4 g / cm3
Punto de fusión y punto de ebullición
Otra propiedad periódica importante está relacionada con las temperaturas a las que los elementos entran en derritiendo y hirviendo.
El punto de fusión (MP) es la temperatura a la que la materia pasa de la fase sólida a la líquida. El Punto de Ebullición (PE) es la temperatura a la que la materia pasa de la fase líquida a la gaseosa.
En la tabla periódica, los valores de PF y PE varían según los lados que se colocan en la tabla.
Verticalmente y en el lado izquierdo de la mesa, aumentan de abajo hacia arriba. En el lado derecho, aumentan de arriba hacia abajo. En dirección horizontal, se extienden desde los extremos hacia el centro.

Variación del punto de fusión y ebullición
Afinidad electrónica
También llamada "electroafinidad", es la energía mínima requerida por un elemento químico para eliminar un electrón de un anión.
Eso es el afinidad electrónica indica la cantidad de energía liberada cuando un átomo recibe un electrón.
Tenga en cuenta que este átomo inestable está solo y en estado gaseoso. Con esta propiedad, adquiere estabilidad cuando recibe el electrón.
En contraste con el radio atómico, la electroafinidad de los elementos de la tabla periódica crece de izquierda a derecha, horizontalmente. En la dirección vertical, aumenta de abajo hacia arriba.
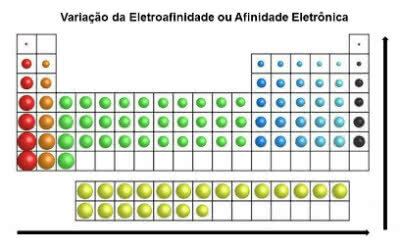
Variación de afinidad electrónica
El elemento químico que tiene mayor afinidad electrónica es el cloro (Cl), con un valor de 349 KJ / mol.
Energía de ionización
También llamado "potencial de ionización”, Esta propiedad es contraria a la de la afinidad electrónica.
Es la energía mínima requerida por un elemento químico para eliminar un electrón de un átomo neutro.
Por lo tanto, esta propiedad periódica indica cuánta energía se necesita para transferir el electrón desde un átomo en un estado fundamental.
El llamado "estado fundamental de un átomo" significa que su número de protones es igual a su número de electrones (p+ = y-).
Por lo tanto, después de eliminar un electrón del átomo, se ioniza. Es decir, obtiene más protones que electrones y, por tanto, se convierte en catión.
En la tabla periódica, la energía de ionización es contraria a la del radio atómico. Entonces aumenta de izquierda a derecha y de abajo hacia arriba.
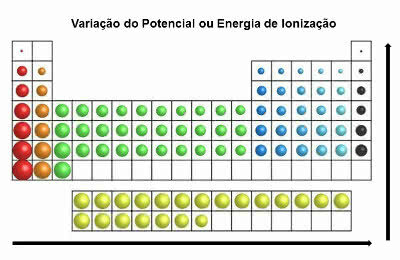
Variación de la energía de ionización
Los elementos que tienen el mayor potencial de ionización son el flúor (F) y el cloro (Cl).
electronegatividad
Propiedad de los átomos de elementos que tienen tendencia a recibir electrones en un enlace químico.
Ocurre en enlaces covalentes al momento de compartir pares de electrones. Al recibir electrones, los átomos quedan con una carga negativa (anión).
Recuerde que esta se considera la propiedad más importante de la tabla periódica. Esto se debe a que la electronegatividad induce el comportamiento de los átomos, a partir de los cuales se forman las moléculas.
En la tabla periódica, el electronegatividad aumenta de izquierda a derecha (horizontalmente) y de abajo hacia arriba (vertical)
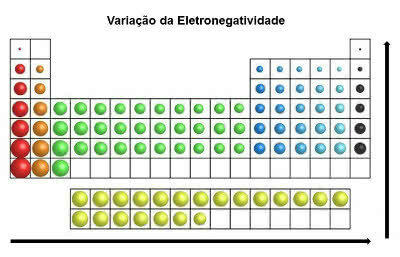
Variación de electronegatividad
Por tanto, el elemento más electronegativo de la tabla periódica es el flúor (F). Por otro lado, el cesio (Cs) y el francio (Fr) son los elementos menos electronegativos.
electropositividad
A diferencia de la electronegatividad, esta propiedad de los átomos elementales indica la tendencia a perder (o ceder) electrones en un enlace químico.
Al perder electrones, los átomos de los elementos adquieren una carga positiva, formando así un catión.
En la misma dirección que el radio atómico y contrariamente a la electronegatividad, en la tabla periódica a electropositividad aumenta de derecha a izquierda (horizontal) y de arriba a abajo (vertical).
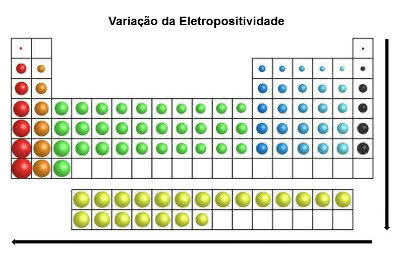
Variación de electropositividad
Los elementos químicos con mayor electropositividad son los metales, por lo que a esta propiedad también se le llama “carácter metálico”. El elemento más electropositivo es el francio (Fr) con máxima tendencia a la oxidación.
¡Atención!
Tú "Gases nobles”Son elementos inertes, ya que no realizan enlaces químicos y apenas donan o reciben electrones. Además, tienen dificultades para reaccionar con otros elementos.
Por tanto, no se consideran la electronegatividad y electropositividad de estos elementos.
Lea también:
- Enlaces químicos
- Historia de la tabla periódica
- Familias de la tabla periódica
Propiedades aperiódicas
Además de las propiedades periódicas, tenemos propiedades aperiódicas. En este caso, los valores aumentan o disminuyen con el número atómico de elementos.
Reciben este nombre, ya que no obedecen a su posición en la tabla periódica como las periódicas. Es decir, no se repiten en periodos regulares.
Las principales propiedades aperiódicas son:
- Masa atomica: Esta propiedad aumenta a medida que aumenta el número atómico.
- Calor especifico: esta propiedad disminuye al aumentar el número atómico. Recuerde que el calor específico es la cantidad de calor necesaria para aumentar la temperatura en 1 ° C de 1 g del elemento.
Ejercicios de examen de ingreso con comentarios
1. (PUC-RJ) Considere las afirmaciones sobre elementos del grupo IA en la tabla periódica
I. Se llaman metales alcalinos.
II. Sus rayos atómicos crecen con el número atómico.
III. Su potencial de ionización aumenta con el número atómico.
IV: Su carácter metálico aumenta con el número atómico.
Entre las afirmaciones, son verdaderas:
a) I y II
b) III y IV
c) I, II y IV
d) II, III y IV
e) I, II, III y IV
Alternativa c
2. (UFMG) Comparando el cloro y el sodio, los dos elementos químicos que forman la sal de mesa, se puede decir que el cloro:
a) es más denso.
b) es menos volátil.
c) tiene un mayor carácter metálico.
d) tiene menor energía de ionización.
e) tiene un radio atómico más pequeño.
Alternativa y
3. (UFC-CE) El efecto fotoeléctrico consiste en la emisión de electrones desde superficies metálicas, mediante la incidencia de luz de frecuencia adecuada. Este fenómeno está directamente influenciado por el potencial de ionización de los metales, que han sido en gran parte utilizado en la fabricación de dispositivos fotoelectrónicos, tales como: fotocélulas de alumbrado público, cámaras fotográfico, etc. Con base en la variación en el potencial de ionización de los elementos en la tabla periódica, marque la alternativa que contiene el metal con mayor probabilidad de exhibir el efecto fotoeléctrico.
a) Fe
b) Hg
c) Cs
d) Mg
e) Ca
Alternativa c
Verifique las preguntas del examen de ingreso con una resolución comentada en Ejercicios de la tabla periódica y preguntas inéditas sobre el tema en Ejercicios para organizar la tabla periódica.
Lea también:
- Tabla periodica
- Distribución electrónica
- Elementos químicos
- Fuerzas intermoleculares
