O principio de Le Chatelier nos dice que cuando se produce una perturbación en un sistema en equilibrio, cambiará en la dirección que minimiza las fuerzas creadas por esa perturbación y restablece un nuevo equilibrio químico.
Una de estas perturbaciones es la variación de temperatura. Esta variación es importante porque, además de provocar el cambio de equilibrio, también cambiará el valor de la constante de equilibrio, KC.
Para que comprenda mejor cómo sucede esto, veamos un ejemplo:
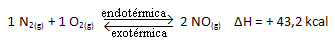
KC = _[ EN EL]2___
[NORTE2]. [O2]
La reacción anterior ocurre en la dirección directa con la absorción de energía, es endotérmica. El proceso inverso, en cambio, ocurre con la liberación de energía, siendo una reacción exotérmica.
Así, si aumentamos la temperatura del sistema, el equilibrio químico se desplazará hacia la reacción endotérmica, que en esta reacción está a la derecha. Esto es para que se absorba el calor y se recupere el equilibrio.
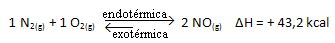
Lo opuesto también es cierto; si bajamos la temperatura de este sistema, la reacción cambiará en la dirección en la que liberará calor, porque la energía total de la reacción disminuirá. Esto significa que el equilibrio se desplazará hacia la reacción exotérmica, que en este caso está a la izquierda:
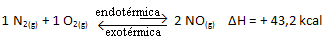
En breve:

En relación con la constante de equilibrio (KC), cuando la temperatura aumenta, favorece la reacción endotérmica y más NO(gramo) se forma, aumentando su concentración y disminuyendo la concentración de reactivos. Tenga en cuenta en la fórmula siguiente que la concentración de NO(gramo) es directamente proporcional a la constante KC, por tanto, también aumenta:
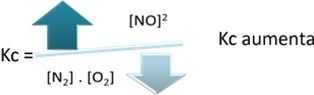
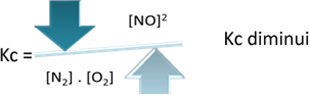
Pero si disminuimos la temperatura, desplazando la reacción hacia la reacción exotérmica, la concentración del producto NO disminuirá y las concentraciones de los reactivos aumentarán. Dado que las concentraciones de reactivos son inversamente proporcionales a la constante Kc, entonces disminuirá:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm