Hibridación de carbono tipo sp2 ocurre cuando tiene un enlace doble y dos enlaces simples o un enlace pi (π) y tres enlaces sigma (σ). De hecho, la hibridación sp2 se produce entre los átomos que establecen el doble enlace.
Un ejemplo de tal molécula es el formaldehído (CH2O). Tenga en cuenta su estructura a continuación:
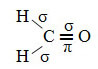
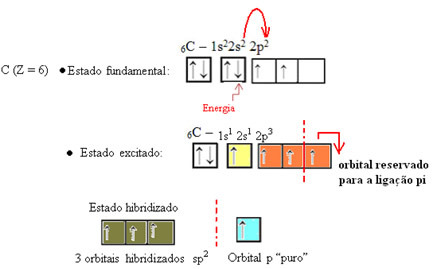
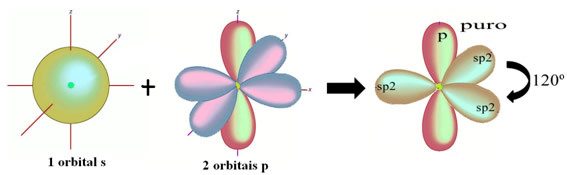
Como se ve en el texto "hibridación de tipo sp3”, La hibridación de carbono ocurre cuando un electrón del subnivel 2s recibe energía y es“ transportado ”al 2p subnivel y, por lo tanto, originan 4 orbitales hibridados de la "mezcla" de orbitales atómicos puro.
En el caso del formaldehído, sabemos que habrá un enlace pi, por lo que uno de estos orbitales hibridados está reservado para este enlace, mientras que los otros tres llevan los enlaces sigma:
Los átomos de hidrógeno que forman el enlace sencillo con el carbono, lo hacen con su orbital s:
El orbital p "puro" restante enlaza el átomo de oxígeno y la molécula de formaldehído tiene la siguiente estructura:
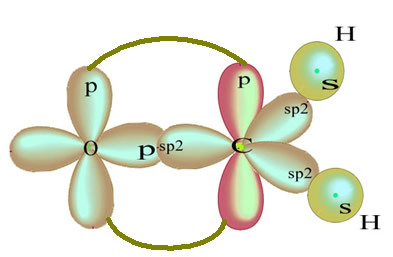
En cuanto al tipo de enlaces existentes en esta estructura de formaldehído, tenemos:

Conexiones: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πpáginas
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm


