Análisis volumétrico o volumetría es un procedimiento de laboratorio en el que utilizamos un cierto volumen de un solución en concentración conocido para determinar la concentración de otra solución. El volumen de la solución de concentración conocida se determinará cuando reaccione completamente con la solución de concentración desconocida, es decir, las soluciones involucradas deben reaccionar entre sí.
Los instrumentos más utilizados para medir un volumen determinado son:
- Pipeta

Ejemplo de pipeta utilizada en la medición de volumen
- Bureta

La bureta es un importante equipo de medición volumétrica.
La medición del volumen se realiza evaluando la altura del llamado menisco., que no es más que la región de la superficie del líquido, que presenta un aspecto rectangular o abovedado (forma de gota), según el grosor del recipiente. Cuanto más ancho es el recipiente, más rectangular es el menisco; cuanto más delgado sea el recipiente, más curvo será. Para valorar el menisco, el ojo debe estar exactamente a su altura y debemos tomar como referencia la región inferior, si el menisco es rectangular, o la punta, si está abultada. Ver una representación de una evaluación:
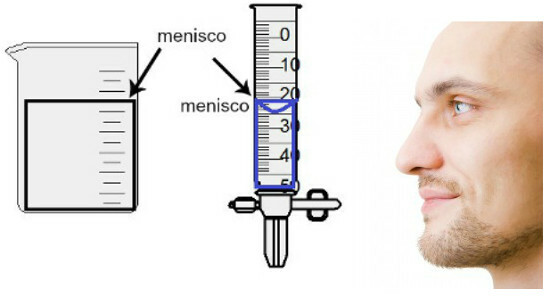
Para evaluar un menisco, es importante que sus ojos miren hacia él.
En análisis volumétrico, el equipo más utilizado es la bureta. Esto se debe a que, como el método implica reacciones químicas y estas se pueden procesar rápidamente, la bureta permite el líquido se libera en su punta en gotas, lo que nos permite evitar que el líquido salga más revisado.
Uno de los procedimientos más utilizados dentro de la volumetría es el valoración. Es un análisis volumétrico que involucra la ocurrencia de una reacción entre un ácido y una base o viceversa. Los equipos necesarios para su realización están representados en la siguiente imagen:
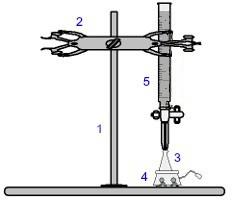
Representación del equipo utilizado en una titulación.
Los números en azul significan:
1) Soporte universal;
2) Garra (utilizada para sujetar la bureta);
3) Erlenmeyer (recibe la solución de concentración desconocida);
4) Agitador magnético (utilizado para agitar la solución presente en el matraz Erlenmeyer);
5) Bureta (recibe la solución de concentración conocida).
Se añade al matraz erlenmeyer un volumen de la solución de concentración desconocida con el indicador de fenolftaleína (inmediatamente la solución se vuelve rosa). En la bureta, se coloca un cierto volumen de la solución de concentración conocida. Luego, la solución ácida de la bureta se vierte directamente en la solución básica en el matraz Erlenmeyer. Este goteo dura hasta que la solución base se vuelve incolora, momento en el que llamamos el punto de inflexión, que indica que toda la base presente en la solución ha reaccionado completamente con el ácido.
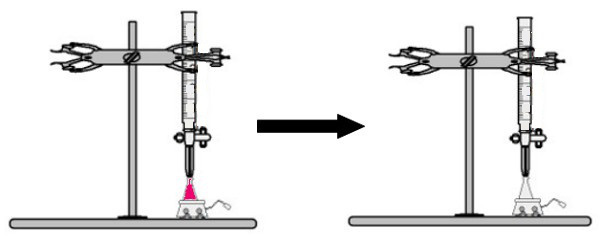
En el punto de inflexión, la solución ya no es rosa y se vuelve incolora.
Observación: Si la solución de concentración desconocida es ácida, cuando reciba el indicador de fenolftaleína, será incolora. Así, el punto de inflexión en la titulación será cuando la solución ácida se vuelva rosa al recibir la solución básica de la bureta.
Finalmente, para determinar la concentración de la solución básica, simplemente use la siguiente ecuación:
Ma.Va = Mb.Vb
Ma = molaridad ácida;
Va = volumen de ácido;
Mb = molaridad base;
Vb = volumen base.
Ahora siga un ejemplo de cómo se realiza el cálculo de una solución con molaridad desconocida.
1º) Se agregaron 30 mL de una solución de base desconocida a un matraz Erlenmeyer con el fin de realizar una titulación para determinar su concentración (molaridad). En la bureta se añadieron 50 ml de una solución ácida con una concentración de 0,2 mol / L. Luego de gotear la solución ácida y hasta que se tituló la solución básica, se observó que en la titulación se utilizaron 20 mL de la solución ácida. Determine la molaridad de la solución base utilizada.
Datos de ejercicio:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / L
Va = 20 mL
Como la molaridad del ácido y su volumen son, respectivamente, 0.2 mol / L y 20 mL, y el volumen de la base utilizada es 30 mL, simplemente use la fórmula de titulación:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / L
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
