se define como hibridación la unión de orbitales atómicos incompletos. Un orbital se clasifica como incompleto cuando solo tiene una electrón dentro de él en lugar de dos. Vea una representación de un orbital incompleto y un orbital completo:

En la imagen A, tenemos un orbital completo; en la imagen B, un orbital incompleto.
La hibridación es un fenómeno natural que ocurre con algunos elementos químicos, como Fósforo, Azufre, Carbono, etc. La hibridación del carbono permite que los átomos de este elemento sean capaces de formar cuatro enlaces químicos, es decir, el carbono solo forma cuatro enlaces después de sufrir el fenómeno de hibridación.
Pero, ¿por qué el carbono se hibrida y forma cuatro enlaces? Para comprender este fenómeno, debemos conocer la distribución electrónica de este elemento:
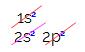
En la distribución electrónica del carbono, vemos que el subnivel 1s está completo (con dos electrones), el 2s es completo (con dos electrones) y el subnivel 2p está incompleto (el subnivel p soporta seis electrones, pero solo hay dos). Distribuyendo los electrones 2p de forma representativa, tenemos que:
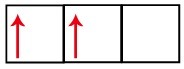
El subnivel p tiene tres orbitales; en el caso del carbono, dos de ellos están incompletos y uno está vacío. Por esta razón, este elemento solo debe realizar dos enlaces, ya que el número de orbitales incompletos siempre determina el número de enlaces.
Sin embargo, al recibir energía del entorno externo, los electrones presentes en el carbono se excitan. Por lo tanto, uno de los electrones presentes en el subnivel 2s se mueve al orbital del subnivel p que estaba vacío:
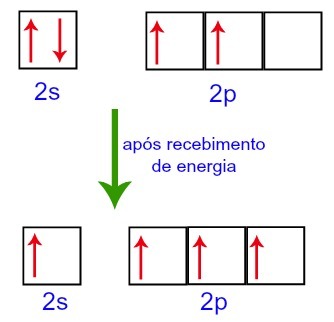
Orbitales de carbono antes y después de recibir energía del entorno externo
Por lo tanto, el carbono se queda con cuatro orbitales incompletos en su segundo nivel. Entonces, el orbital de subnivel 2s se une a los tres orbitales p, lo que configura el fenómeno de hibridación.
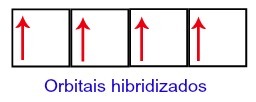
Orbitales de carbono después de la hibridación
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm
