Hidrocarburos, también llamados carburos de hidrogeno, son compuestos orgánicos cuya composición solo tiene átomos de carbón (C) y de hidrógeno (H), por lo que tiene la fórmula general CXHy.
Un hidrocarburo consta de una estructura de carbono a la que se unen los átomos de hidrógeno en enlace covalente.
Es el compuesto más importante de la química orgánica.
Todos los tipos de hidrocarburos se oxidan fácilmente, liberando calor. La mayoría de ellos no son solubles en agua.
Los hidrocarburos naturales son compuestos químicos que se forman dentro de la Tierra (a más de 150 km de profundidad) a alta presión y alcanzar zonas de menor presión a través de procesos geológicos.
¿Dónde se encuentran los hidrocarburos?
La principal fuente de hidrocarburos es el petróleo. Debido a esto, el hidrocarburo está presente en varios derivados como queroseno, parafina, gas natural, Gasolina, Vaselina, diesel, GLP (Gas de petróleo licuado), polímeros (como plástico y caucho), entre otros.
Este compuesto orgánico constituye el 48% de la matriz energética de Brasil.
La cadena de carbono que constituye parte de la composición de un hidrocarburo es tetravalente, es decir, puede hacer cuatro conexiones.
El carbono puede unirse con otros átomos de carbono y con hidrógenos a través de enlaces simples, dobles o triples.
Clasificación de hidrocarburos
La clasificación de los hidrocarburos se basa en tres especificidades: a molde de la cadena de carbono principal, el Conexiones de las cadenas de carbono, el presencia de radicales alquilo en la cadena de carbono y presencia de heteroátomos dividiendo la cadena de carbono.
conocer más sobre hidrógeno.
Forma de la cadena de carbono principal
Con respecto a la forma de la cadena principal de carbono, la clasificación de los hidrocarburos se subdivide en alifático y cíclico.
Compruebe en qué consiste cada una de estas formas de cadena de carbono.
hidrocarburos alifáticos
Los hidrocarburos alifáticos están formados por cadenas de carbono. abierto o acíclico. En estas cadenas, los carbonos son terminales.
Ejemplos de:
alcano
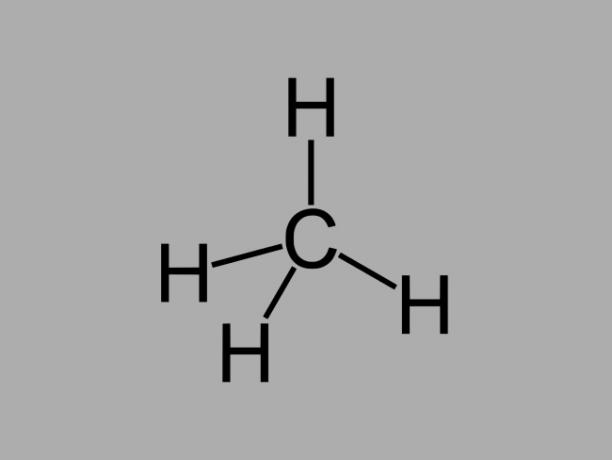
Hidrocarburos alcanos, también llamados parafinas o parafínico, son compuestos aceitosos donde solo hay enlaces simples entre los carbonos.
La fórmula general de un alcano es CNoH2No + 2 (n = cualquier número entero).
alqueno
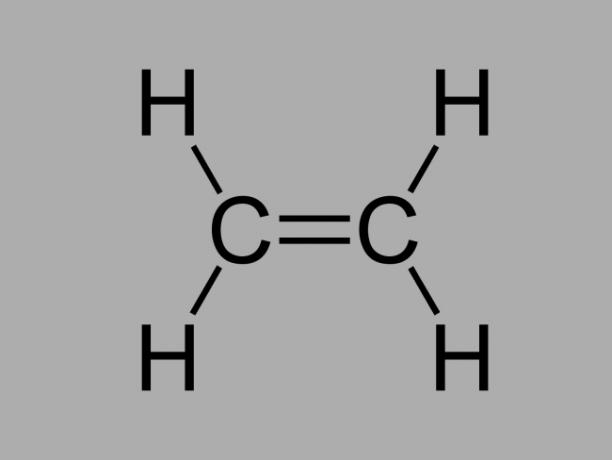
También llamado olefina, alqueno o hidrocarburo de etileno, el alqueno es un compuesto poco reactivo donde hay un doble enlace entre los carbonos.
La fórmula general de un alqueno es CNoH2No.
alquino
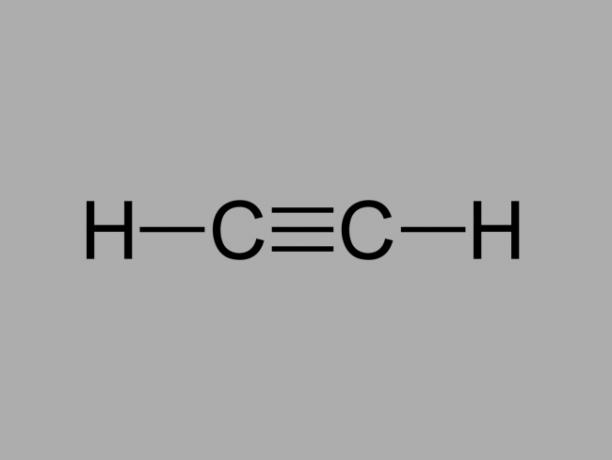
También llamado metilacetileno, el alquino es un hidrocarburo donde los enlaces existentes entre los carbonos son triples.
La fórmula general de un alquino es CNoH2No-2.
alcadieno

También llamados dienos o diolefinas, los alcadienos son hidrocarburos donde los enlaces entre los carbonos son dobles.
La fórmula general de un alcadieno es CNoH2No-2.
Hidrocarburos cíclicos
Los hidrocarburos cíclicos están formados por cadenas de carbono cerradas o cíclicas. Estas cadenas no tienen carbonos terminales.
Ejemplos de:
Cyclan
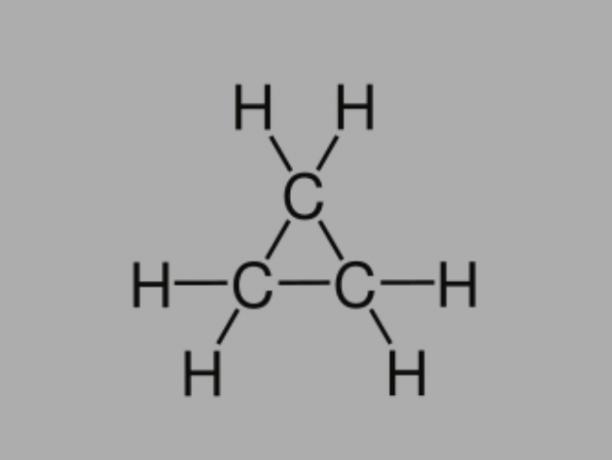
También llamado cicloalcano, cicloparafina o hidrocarburo nafténico, el ciclano es un hidrocarburo saturado, compuesto por enlaces simples.
Tiene una cadena de carbono cerrada y su fórmula general es CNoH2No.
De ciclón

También llamado cicloalquenos, los cicenos son hidrocarburos insaturados, compuestos por dobles enlaces.
Un ciclone tiene una cadena de carbono cerrada y su fórmula general es CNoH2No−2.
ciclista
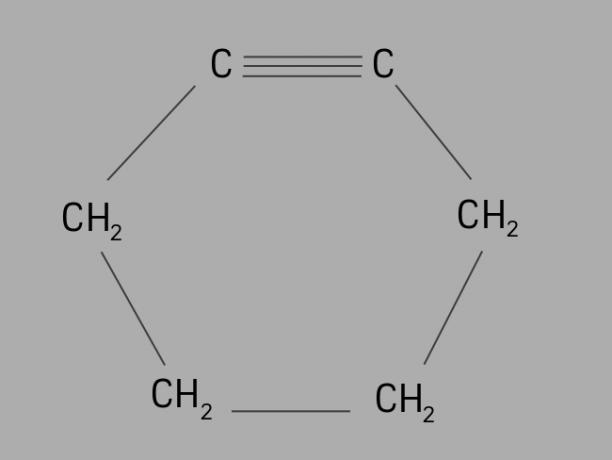
También llamado cicloalquino o cicloalquino, la ciclina es un hidrocarburo cíclico e insaturado.
Está formado por una cadena carbonada cerrada, con triples enlaces y su fórmula general es CNoH2No-4.
Aromático

o

También llamado arenas, los hidrocarburos aromáticos son compuestos insaturados formados por dobles enlaces.
Un aromático tiene una cadena de carbono cerrada o cíclica y su fórmula general es C6H6.
Tipo de unión de cadenas de carbono
Dependiendo del tipo de enlace de las cadenas de carbono, los hidrocarburos se pueden clasificar en saturado o insaturado.
Vea a continuación en qué consiste cada una de estas clasificaciones.
Hidrocarburos saturados
Los hidrocarburos saturados están formados por enlaces simples.
Ejemplos de: alcanos, ciclanos.
hidrocarburos insaturados
Los hidrocarburos insaturados están formados por dobles enlaces o triples.
Ejemplos de: alquenos, alquinos, alcadienos.
Presencia de radicales alquilo
En cuanto a la presencia de radicales alquilo, los hidrocarburos pueden tener una cadena de carbono normal o ramificado.
cadena de carbono normal
Un hidrocarburo de cadena carbonada normal no tiene radicales alquilo.
Ejemplo: pentano
cadena de carbono ramificada
Cuando un hidrocarburo tiene una cadena de carbono ramificada, significa que su cadena de carbono principal tiene radicales alquilo.
Ejemplo: metilpropano
Presencia de heteroátomos que dividen la cadena de carbono.
La cadena de carbono secuencial puede o no dividirse dependiendo de la presencia de heteroátomos.
Cadena de carbono homogénea
Cuando un hidrocarburo tiene una cadena de carbono principal homogénea, significa que esta cadena no esta dividido por heteroátomos.
Cadena de carbono heterogénea
Si un hidrocarburo tiene una cadena de carbono principal heterogénea, esta cadena tiene su cadena de carbono dividida por un heteroátomo.
Nomenclatura de hidrocarburos
La nomenclatura de los hidrocarburos se define mediante una combinación de tres partes:

El prefijo identifica la cantidad de carbonos, el intermedio identifica el tipo de enlace y el sufijo indica la función a la que pertenece el compuesto (en este caso, la clase de hidrocarburos).
Consulte a continuación la lista de prefijos e intermedios que se combinan para designar hidrocarburos.
Lista de prefijos
| Numero de carbonos | Prefijo |
|---|---|
| 1 | Reunió- |
| 2 | Et- |
| 3 | Apuntalar- |
| 4 | Pero- |
| 5 | encerrado- |
| 6 | Maleficio- |
| 7 | Hept- |
| 8 | Oct- |
| 9 | No- |
| 10 | Dic- |
Lista de intermediarios
| Tipo de conección | Intermediario |
|---|---|
| Solo llamadas individuales | -un- |
| Par | -en- |
| triple | -en- |
| dos pares | -dien- |
Mire algunos ejemplos de nombres de hidrocarburos.
Ejemplos de:
CH3 - CH2 - CH2 - CH3
En la forma estructural anterior, podemos ver un compuesto de 4 carbonos que solo tiene enlaces simples (indicado por el símbolo “-”).
- Prefijo para 4 carbonos = but-
- Intermedio para enlace simple = -an-
- Sufijo de un hidrocarburo = -o
Ver que la unión de prefijo + intermedio + sufijo da lugar al nombre BUTANO.
CH2 = CH2
La forma estructural anterior tiene 2 carbonos y 1 doble enlace (indicado por el símbolo "=").
- Prefijo para 2 carbonos = et-
- Intermedio para dobles enlaces = -en-
- Sufijo de un hidrocarburo = -o
Ver que la unión de prefijo + intermedio + sufijo da lugar al nombre ETENE.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
Tenga en cuenta que las dos formas estructurales anteriores tienen 4 carbonos y 1 doble enlace (indicado por el símbolo "=").
Así tenemos:
- Prefijo para 4 carbonos = but-
- Intermedio para dobles enlaces = -en-
- Sufijo de un hidrocarburo = -o
Ver que la unión de prefijo + intermedio + sufijo daría lugar al nombre BUTENE para las dos formas estructurales.
Sin embargo, tenga en cuenta que las formas estructurales no son idénticas, por lo que las nomenclaturas tampoco pueden serlo.
La diferencia entre las dos formas estructurales radica en la ubicación del doble enlace.
En este caso, debemos numerar los carbonos de la cadena desde el extremo más cercano al doble. Por tanto, en los casos en cuestión, debemos numerar de izquierda a derecha.
En CH2 = CH - CH2 - CH3:
- CH2 será el 1
- CH será el 2
- CH2 será el 3
- CH3 será el 4
Tenga en cuenta que el doble enlace está entre el carbono 1 es el carbono 2.
Debemos usar el número más pequeño (1) para encontrar el doble enlace: BUTENO -1
En CH3 - CH = CH2 - CH3:
- CH3 será el 1
- CH será el 2
- CH2 será el 3
- CH3 será el 4
Tenga en cuenta que el doble enlace se encuentra entre carbono 2 es el carbono 3.
Debemos usar el número más pequeño (2) para encontrar el doble enlace: BUTENO -2
De acuerdo a IUPAC (Unión internacional de Química Pura Aplicada - Unión Internacional de Química Pura y Aplicada), la ubicación debe indicarse un poco antes de la estar ubicado (en el caso de los formales estructurales anteriores, el doble enlace, representado por el intermedio “-En-”).
Con eso, tenemos una segunda forma, que por cierto es la más correcta, de escribir la nomenclatura de las formas estructurales disponibles.
CH2 = CH - CH2 - CH3: BUTENE -1 o BUT-1-ENO (forma más correcta)
CH3 - CH = CH2 - CH3: BUTENE -2 o BUT-2-ENE (forma más correcta)
Aprender más sobre IUPAC y nomenclatura.


