Cuando se mezclan dos soluciones, diferentes o no, es necesario analizar primero si existe o no una reacción entre ellas. Por ejemplo, si mezclamos una solución de agua con azúcar (solución acuosa de sacarosa) con una solución de agua con sal (salmuera), obtendremos un mezcla de soluciones sin reacciones químicas.
Lo mismo ocurre si mezclamos dos soluciones de cloruro de sodio (NaCl), con diferentes concentraciones. En este caso, tampoco habrá reacción. Entonces podemos definir este ejemplo como un mezcla de soluciones del mismo soluto, sin ninguna reacción química, donde el primer ejemplo es un mezcla de soluciones de diferentes solutos, sin reacción química.
En ambos casos, la composición química de los componentes de las soluciones no cambiará.sin embargo, habrá que volver a calcular algunos aspectos cuantitativos.
Para entender cómo podríamos determinar la concentración molar (Molaridad) y la concentración común de una mezcla de soluciones sin reacción, veamos la resolución de los dos casos mencionados:
1o) Mezcla de soluciones de un mismo soluto, sin que se produzca reacción química:

Imagine que mezclamos dos soluciones de cloruro de sodio, una con una concentración de 2.0 g / L en 60.0 mL de solución y la otra con 2.5 g / L en 80 mL de volumen de solución.
Dado que no se produce ninguna reacción, tanto la masa como el volumen son solo la suma de las masas y volúmenes iniciales:
m (solución) = m1 (NaCl) + m2 (NaCl)
metro1 (NaCl) = v. Cm2 (NaCl) = v. C
metro1 (NaCl) = 0,06 l. 2,0 g / l m2 (NaCl) = 0,08 l. 2,5 g / L
metro1 (NaCl) = 0,1 g2 (NaCl) = 0,2 g
m (solución) = 0,1 g + 0,2 g
m (solución) = 0,3 g
v (solución) = v1 (NaCl) + v2 (NaCl)
v (solución) = (60 + 80) mL
v (solución) = 140 mL = 0.14 L
A continuación, se puede obtener la concentración utilizando estos datos:
C (solución) = m (solución)
v (solución)
C (solución) = 0,3 g
0,14 L
C (solución)≈ 2,14 g / L
2o) Mezcla de soluciones de diferentes solutos, sin que se produzca reacción química:
Tomemos por ejemplo la mezcla entre 500 ml de una solución acuosa de sacarosa (C12H22O11) que inicialmente tenía una concentración de 18.0 g / L, con 1 L de una solución de agua salada (solución acuosa de cloruro de sodio - NaCl) con una concentración de 100.0 g / L.
No pares ahora... Hay más después de la publicidad;)
Después de mezclar, ¿cuál fue la molaridad, la concentración común, la masa y el volumen de la solución resultante de la mezcla?
Como no hubo reacción química, las masas de C12H22O11 y NaCl permanecen sin cambios. Y los valores de masa iniciales se pueden lograr mediante una simple regla de tres utilizando concentraciones de reacción.
18,0 g 1 L
m (C12H22O11) 0.5L
m (C12H22O11) = 9,0 g
m (NaCl) 100,0 gramo
La masa también se puede lograr mediante la fórmula:
m = v. C
m (C12H22O11) = 0,5 L. 18 g / L
m (C12H22O11) = 9,0 g
m (NaCl) = 1 L. 100,0 g / L
m (NaCl) = 100,0 g
Por tanto, la masa total de la solución es la suma de las dos masas:
m (solución) = m (C12H22O11) + m (NaCl)
m (solución) = 109,0 g
El volumen es simplemente la suma de los volúmenes iniciales, por lo que tenemos:
v (solución final) = v (C12H22O11) + v (NaCl)
v (solución final) = (0.5 + 1) L
v (solución final) = 1,5 L
La concentración final se logra calculando por separado las concentraciones de cada uno de los solutos. Dado que no reaccionan entre sí y sus masas no cambian, podemos utilizar la siguiente fórmula de concentración:
C = metro
v
inicial = minicial final c = mFinal
vinicial vFinal
metroinicial = mFinal
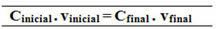
C (C12H22O11) =?
Cinicial. vinicial = CFinal. vFinal
18,0 g / L. 0,5 L = CFinal .1,5 L
C (C12H22O11) Final = 6,0 g / L
C (NaCl) =?
Cinicial. vinicial = CFinal. vFinal
100,0 g / L. 1 L = Cfinal .1.5 L
C (NaCl)Final = 66,67 g / L
La relación hecha para esta fórmula de la concentración común también se puede hacer para calcular la molaridad (MI. vI = MF. vF) y para la concentración en masa por masa (Título - TI. vI = TF. vF).
Por Jennifer Fogaça
Licenciada en Química