Isomería es un fenómeno natural en el que diferentes sustancias (en términos de propiedades químicas y físicas) tienen exactamente la misma fórmula molecular, como en el siguiente ejemplo:
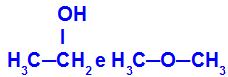
Diferentes sustancias que tienen la misma fórmula molecular.
El etanol (izquierda) tiene la fórmula molecular C2H6O, que también ocurre con el metoxietano (derecha), por lo que son isómeros.
Tipos de isomería
→ isómero plano
Es el tipo de isomería que estudia las diferencias estructurales entre isómeros.
La) Ocupación
Es el tipo de isomería plana en la que la diferencia entre sustancias se basa en la diferencia entre las funciones orgánicas a las que pertenecen. Vea algunos ejemplos:
Propanona y propano:
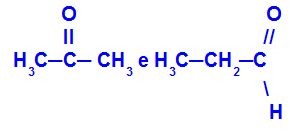
Isómeros pertenecientes a diferentes funciones.
La propanona (izquierda) pertenece al grupo de las cetonas y el propanal (derecha) pertenece al grupo de los aldehídos.
B) Celda
Es el tipo de isomería plana en la que la diferencia entre sustancias se basa en la diferencia entre las cadenas que presentan. Vea un ejemplo:
2-metilpropano y butano
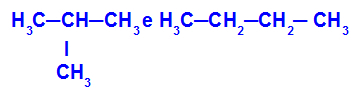
Isómeros que tienen cadenas con diferentes clasificaciones.
En el ejemplo, podemos ver que el 2-metilpropano (a la izquierda) tiene una cadena ramificada y el butano (a la derecha) tiene una cadena normal.
C) Posición
Es el tipo de isomería plana en la que la diferencia entre sustancias se basa en la diferencia de posición de un componente presente en sus cadenas. Vea un ejemplo:
1-cloro-propano y 2-cloro-propano
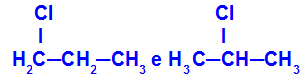
Isómeros que tienen componentes en diferentes posiciones de la cadena.
En el ejemplo, podemos ver que el 1-cloropropano (a la izquierda) tiene el cloro posicionado en el carbono 1, y el 2-cloropropano (a la derecha) tiene el cloro posicionado en el carbono 2.
D) Metameria o compensación
NOTA: Isomería válida exclusivamente para cadenas heterogéneas.
Es el tipo de isomería plana en la que la diferencia entre las sustancias se basa en la diferencia de posición de un heteroátomo presente en sus cadenas. Vea un ejemplo:
Ejemplo: Metoxipropano y etoxietano
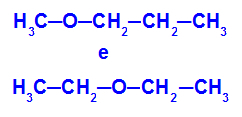
Isómeros que tienen heteroátomos en diferentes posiciones de la cadena.
En el ejemplo, podemos ver que, en el metoxipropano (izquierda), el oxígeno tiene un radical con un carbono en un lado y tres carbonos en el otro. En el etoxietano (derecha), el oxígeno tiene un radical con dos carbonos en un lado y dos carbonos en el otro.
y)Tautomery
Es un caso particular de isomería de función plana y ocurre solo en tres funciones orgánicas:
Aldehído
cetona
Enol
Este tipo de isomería se basa en el hecho de que existe un equilibrio químico entre un enol y un aldehído y entre un enol y una cetona, es decir, estos componentes se convierten constantemente entre sí. Vea un ejemplo:
Prop-2-en-1-ol y propanona
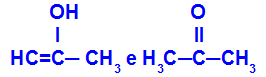
Isómeros pertenecientes a diferentes funciones.
En el ejemplo, podemos ver que el Prop-2-en-1-ol (a la izquierda) pertenece al grupo de enoles, y la propanona (a la derecha) pertenece al grupo de cetonas, por lo que son isómeros de tautomería.
→ Isomería espacial
Es un tipo de isomería definida por el análisis espacial de la molécula.
a) Isómeros geométricos
No pares ahora... Hay más después de la publicidad;)
Es un tipo de isomería espacial que ocurre cuando la sustancia tiene moléculas con las siguientes características:
Cadena cerrada que tiene dos carbonos con dos ligandos diferentes, como en el siguiente ejemplo:

Estructura cerrada con isomería geométrica
Cadena abierta que tiene un doble enlace entre los carbonos y, en cada uno de estos carbonos del doble enlace, existen dos ligandos diferentes, como en el siguiente ejemplo:
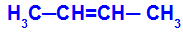
Estructura abierta con isomería geométrica
La isomería geométrica se divide en dos grupos:
1O Grupo: cis-trans
Ocurre cuando los dos ligandos de un carbono son estrictamente iguales a los dos ligandos del otro carbono, ya sea en la estructura abierta o en la estructura cerrada.
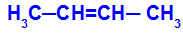
Cadena de una sustancia que tiene isomería cis-trans
El isómero se denominará cis cuando los mismos ligandos estén en el mismo plano.

Ejemplo de un isómero cis
El isómero se denominará trans cuando los diferentes ligandos se encuentren en el mismo plano.

Ejemplo de un isómero trans
2O Grupo: E-Z
Ocurre cuando los dos ligandos de un carbono son diferentes en relación con los dos ligandos del otro carbono, ya sea en la estructura abierta o en la estructura cerrada.

Cadena de una sustancia que tiene isomería E-Z
El isómero se denominará E cuando los ligandos con mayor número atómico se encuentren en planos opuestos. En el siguiente ejemplo, el carbono de la izquierda tiene el Br con el número atómico más alto (35) y, en el otro, está el oxígeno (8).
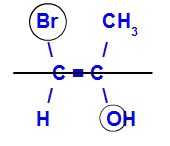
Ejemplo de un isómero E
El isómero se denominará Z cuando los ligandos con mayor número atómico se encuentren en el mismo plano. En el siguiente ejemplo, el carbono de la izquierda tiene el Br con el número atómico más alto (35) y, en el otro, está el oxígeno (8).

Ejemplo de un isómero Z
B) isómero óptico
Es un tipo de isomería espacial que solo ocurre si la sustancia tiene moléculas con carbono quiral (el que tiene cuatro ligandos diferentes) en sus estructuras. La molécula con carbono quiral tiene la capacidad de polarizar y desviar la luz, de la siguiente manera:
A la derecha (isómero de la derecha)
A la izquierda (isómero levógiro)
Un compuesto con actividad óptica siempre tiene isómeros activos (llamados antípodas ópticos) e isómeros inactivos (mezcla entre dos isómeros activos, una mezcla denominada racémica).
Podemos usar la siguiente fórmula para determinar el número de isómeros activos (IOA) e inactivos (IOI) de un compuesto que tiene carbono quiral:
IOA = 2No
IOI = 2No
2
A continuación se muestra un ejemplo de un compuesto que tiene isomería geométrica:
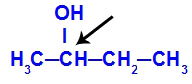
Carbón quiral presentado en butan-2-ol
La estructura del butan-2-ol tiene los siguientes ligandos:
Metilo (CH3)
Etilo (CH3-CH2)
Hidrógeno (H)
Hidroxilo (OH)
Debido a que solo tiene un carbono quiral, el butan-2-ol tiene:
Isómeros activos:
IOA = 21
IOA = 2
Isómeros inactivos:
IOI = 21
2
IOI = 2
2
IOI = 1
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "¿Qué es la isomería?"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Consultado el 27 de junio de 2021.