A enlaces covalentes, también llamado enlaces moleculares u homopolares, son los que ocurren entre átomos de elementos electronegativos, es decir, con tendencia a recibir electrones, estableciendo un enlace de compartiendo electrones de sus capas de valencia.
La unión covalente puede ocurrir entre los siguientes elementos: hidrógeno, no metales y semimetales. Los metales nunca participan en este tipo de unión.
Consideremos un ejemplo simple de enlace covalente: el enlace formador de gas hidrógeno (H2):
H + H → H2
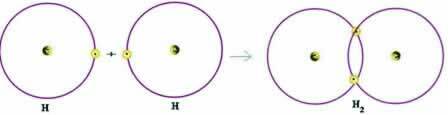
Tenga en cuenta que ambos átomos necesitaban recibir un electrón para completar su capa de valencia, de acuerdo con la regla del octeto, y, de esta manera, permanecer estables. Por lo tanto, compartían sus electrones y, de esta manera, ambos tenían dos electrones, tenían su capa K completa y adquirieron la configuración del gas noble helio.
Este intercambio de electrones es lo que diferencia este tipo de enlace del enlace iónico, en el que tiene lugar la transferencia de electrones.
Consulte la figura siguiente para ver dos ejemplos más de este caso:
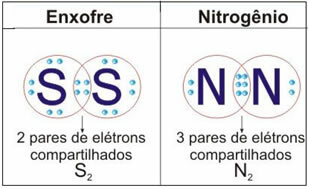
No pares ahora... Hay más después de la publicidad;)
En este tipo de enlace existe la formación de moléculas, las cuales pueden ser representadas por sus respectivos fórmulas moleculares, es decir, la representación más simple que indica cuántos átomos de cada elemento hay en la molécula. Algunos ejemplos de fórmulas moleculares son: H2, S2, O2, No2, H2O, CO2etc.
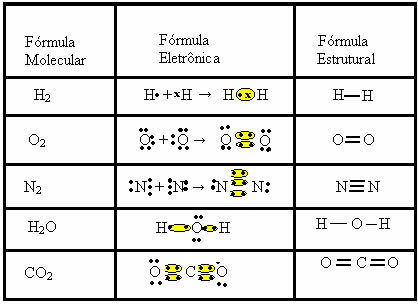
El enlace covalente se puede representar mediante otras dos fórmulas:
- Fórmula electrónica o fórmula de Lewis: en esta fórmula también aparecen los electrones de la capa de valencia de cada átomo y la formación de pares electrónicos. Estos electrones están simbolizados por los signos . o x;
- Fórmula estructural plana o fórmula estructural de cupé: muestra los enlaces de los elementos, con cada par compartido correspondiente a un guión. Si es solo un guión, lo llamamos un solo enlace; si hay dos, doble enlace; y si hay tres guiones, triple enlace.
Tenga en cuenta otros ejemplos de enlaces covalentes representados por estas tres fórmulas químicas:
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Enlaces covalentes"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Consultado el 27 de junio de 2021.


