Una solución es una mezcla homogénea de dos o más sustancias.. Como, por ejemplo, una solución de sal (soluto) disuelta en agua (disolvente).

Especialmente en laboratorios e industrias químicas, este proceso es muy importante, porque el químico necesita preparar soluciones con concentraciones conocidas. Además, en las actividades experimentales se utilizan soluciones con concentraciones muy bajas, por lo que una muestra de la solución concentrada se diluye a la concentración deseada.
Diariamente, varias veces, sin siquiera darnos cuenta, realizamos el proceso de diluir soluciones. Por ejemplo, el empaque de productos de limpieza e higiene doméstica, como desinfectantes, aconseja que se diluyan antes de su uso. Algunos fabricantes sugieren en las etiquetas de los productos que se diluya con agua en una proporción de 1 a 3, es decir, por cada parte del producto se deben agregar 3 partes de agua. Esto se hace porque el producto es muy concentrado y fuerte y puede dañar el lugar donde se aplicará si no se diluye de la forma correcta. Por otro lado, si lo diluyes más de lo debido, puedes perder dinero, porque el producto no logrará el resultado deseado.

Otro ejemplo es cuando hacemos jugos. Las etiquetas de muchos jugos concentrados indican que un vaso de jugo debe diluirse o mezclarse con 5 vasos de agua. Así, el jugo es más "débil", es decir, menos concentrado.
No pares ahora... Hay más después de la publicidad;)
Imagina que has diluido tal jugo en 3 L de agua. Si la concentración inicial de jugo fue de 40 g / L, significa que tenía una masa de 40 g por cada litro de solvente. Pero como tendremos 3 L, la masa se dividirá por 3 y la concentración será de aproximadamente 13, 33 g / L o 13 gramos por cada litro de solución. Sin embargo, en toda la solución permanece la masa del soluto de 40 g.
El cálculo de esta nueva concentración se puede realizar de la siguiente manera:
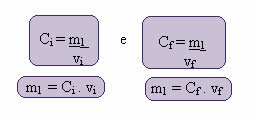
Donde los índices i y f representan, respectivamente, los valores inicial y final. Dado que el valor de m1 no ha cambiado, podemos igualar las ecuaciones:
CI. vI = CF. vF
Reemplazando los valores que tenemos, según el ejemplo anterior, tenga en cuenta:
Solución inicial:
CI: 40 g / L
m1: 40g
vI: 1 litro
Solución final:
CF: ?
m1: 40g
vF: 3L
CI. vI = CF. vF
(40 g / L). (1 L) = CF. 3L
CF = 40 g / L
3
CF = 13,333 g / L
El mismo razonamiento también es válido para la concentración molar (M) y para el porcentaje en masa de soluto o título (T):
METROI. vI = MF. vF y TI. vI = TF. vF
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Dilución de Soluciones"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Consultado el 27 de junio de 2021.



