Equilibriotérmico es la condición en la que un cuerpo se encuentra en el mismotemperatura que su entorno. Se observa que todos los cuerpos que se encuentran a temperaturas más altas que sus vecinos tienden a darles calor de manera espontánea hasta que ambos comienzan a presentar la misma temperatura.
veaademás:Fundamentos de termología
Equilibrio térmico y ley cero de la termodinámica
El equilibrio térmico es el concepto central detrás de la ley cero de la termodinámica. Dicha ley establece que, en el caso de dos sistemas termodinámicos, LA y B, están en equilibrio térmico con un tercer sistema termodinámico, C, luego, LA y B también estarán en equilibrio térmico.
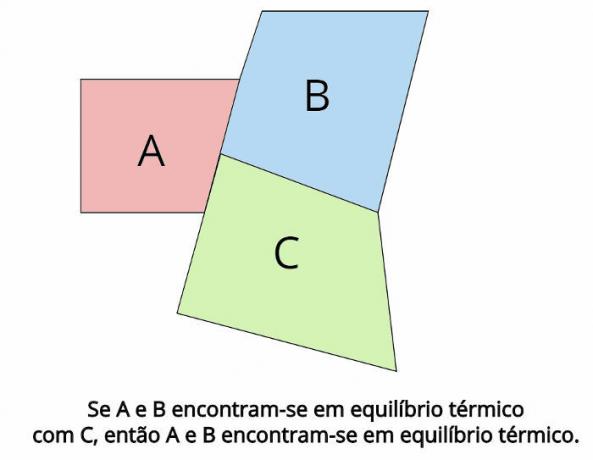
En equilibrio térmico, las temperaturas finales de cada cuerpo deben ser iguales: TLA = TB = TC
Vea lo que establece el enunciado de la ley cero de la termodinámica:
“Si dos cuerpos están en equilibrio térmico con un tercer cuerpo, entonces esos cuerpos estarán en equilibrio térmico entre sí ".
Otra forma de entender el equilibrio térmico se basa en la energía interna de los cuerpos. La energía interna, o simplemente energía térmica, es una cantidad física
directamenteproporcional à temperatura del cuerpo. Por lo tanto, si hay cuerpos con diferentes temperaturas dentro de un mismo sistema termodinámico, tendrán diferentes módulos de energía interna y, por lo tanto, transferirá parte de esa energía entre ellos hasta que no haya diferencia entre sus energías. interno. ¿Quieres saber más sobre qué es la energía interna y cuáles son sus propiedades? Accede al artículo: Energía interna.calor y equilibrio térmico
La transferencia de calor siempre ocurre espontáneamente, desde el cuerpo con la temperatura más alta al cuerpo con la temperatura más baja. Esta transferencia de energía en forma de calor puede ocurrir a través de procesos como conduciendo, convección y radiación.
Conduciendo: Es la transferencia de calor entre cuerpos que ocurre especialmente en sólidos. En este tipo de conducción, no se producen transferencias de masa. Este tipo de transferencia de calor explica cómo se produce el equilibrio térmico en los metales, por ejemplo.
Convección: Es una transferencia de calor que tiene lugar en fluidos. En este modo de transferencia de calor, hay transferencia de masa, a medida que el fluido calentado se mueve, formando corrientes de convección hasta que todo el fluido alcanza el equilibrio térmico.
Radiación: Es la transmisión de calor a través de ondas electromagnéticas, por lo tanto, este proceso ocurre incluso si no existe un medio físico entre el cuerpo y otro cuerpo a diferentes temperaturas. El calor que se transfiere, en este caso, es el equivalente a ondas electromagnéticas con menos energía que luz visible, siendo por tanto radiación térmica, localizada en la región del infrarrojo.
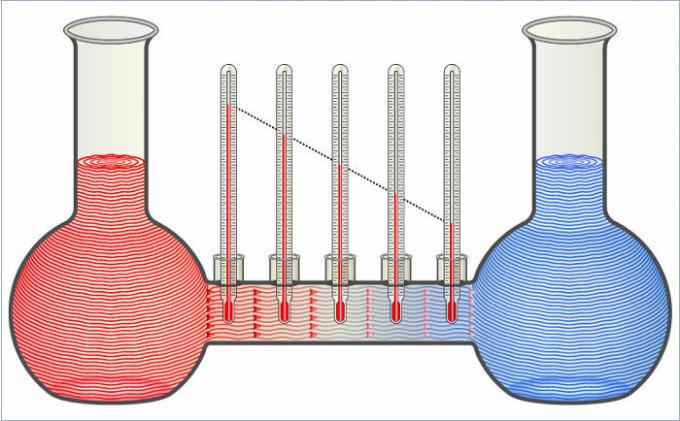
Los dos líquidos de la figura se transfieren calor entre sí hasta que sus temperaturas son iguales.
¿Quieres saber más sobre cómo se desarrolla cada uno de los procesos de transferencia de calor? Accede al artículo: Procesos de propagación de calor.
calor sensible
cuando hay diferenciaentemperatura entre dos cuerpos, o entre un cuerpo y su entorno, habrá un intercambio de calor entre ellos de forma espontánea, de modo que el el cuerpo a temperatura más alta se enfría y los cuerpos a temperatura más baja se calientan hasta que todos alcanzan la temperatura en equilibriotérmico.
La cantidad de calor que se intercambia entre los cuerpos a diferentes temperaturas se llama calor sensible y esta cantidad se puede calcular a partir de la fórmula que se muestra en la siguiente figura:
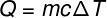
Q - calor (lima o J)
metro - masa (go kg)
C - calor específico (cal / gºC o J / kg. K)
ΔT - variación de temperatura (° C o K)
En la fórmula que se muestra arriba, es importante resaltar la grandeza del nombre calor especifico. tal magnitud mide el cantidad de energía por masa que una sustancia necesita para producir, o absorber, para que su temperatura varíe en 1 ° C. En el caso del agua pura, por ejemplo, y en condiciones normales de presión, para variar su temperatura en 1ºC, se necesita 1,0 caloría por cada gramo de agua.
Así, todas las sustancias que han establecido contacto térmico entre sí tienden a alcanzar la condición de equilibriotérmico Sin embargo, con el tiempo de forma espontánea, algunos requieren una mayor cantidad de energía para hacerlo y esto afecta directamente a la temperatura para alcanzar el equilibrio térmico.
leerademás:¿Qué es la temperatura?
calor latente
Es posible que durante los intercambios de calor con su entorno, un cuerpo presente presión, temperatura y volumen que provoquen un cambio en su estado físico. Estos cambios ocurren en temperaturaconstante (para cuerpos compuestos por una sola sustancia, sin impurezas), es decir, a pesar de recibir o dar calor al ambiente externo, la temperatura de estos cuerpos no cambia.
Esto solo es posible porque toda la energía intercambiada, en este caso, se está utilizando para cambiar la conformación de sus moléculas. Desde el momento en que se "supera" la barrera energética y todo el contenido del cuerpo se encuentra en otro estado físico, el El cuerpo continúa intercambiando calor con su entorno, a menos que, por supuesto, su temperatura sea igual a la temperatura exterior.
O calor latente se puede calcular a partir de la fórmula que se muestra en la figura siguiente, compruébalo:
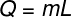
Q - calor latente (cal o J)
metro - masa (go kg)
L - calor latente específico (cal / go J / kg)
Fórmula de equilibrio térmico
En caso de que queramos averiguar cuál es el temperaturaenequilibrio de algún sistema termodinámico, es necesario que consideremos el sistema en cuestión como un sistemaaislado, es decir, debemos asumir que no se intercambia ninguna cantidad de calor con los alrededores de este sistema.
A partir de esta condición, podemos decir que la totalidad de la cantidad de calor intercambiada se intercambia solo entre los cuerpos que componen este sistema, sin tener en cuenta las pérdidas de calor para las paredes del contenedor, por ejemplo. En este caso, decimos que el contenedor tiene capacidad térmica insignificante, es decir, no absorbe calor.
Imagina la siguiente situación: en una taza de té caliente, con una capacidad calorífica insignificante, vierte unos cubitos de hielo. Para determinar la temperatura de equilibrio térmico, además de conocer las condiciones iniciales del sistema, debemos hacer algunas consideraciones:
Toda la cantidad de calor que el té caliente le da al hielo será absorbido completamente por éste, ya que la taza tiene una capacidad calorífica insignificante.
Debemos descartar las pérdidas de calor al aire y cualquier otro entorno, para que esta taza de té pueda entenderse como un sistema termodinámico cerrado.
De esta forma, podemos establecer que la totalidad del calor recibido por el hielo fue cedido por el té caliente, con eso escribimos nuestra fórmula para calcular el balance térmico:
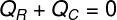
QR - Calor recibido
QC - calor dado en
El calor dado en (QC), se refiere a la cantidad de calor que el té caliente transfirió a los cubitos de hielo insertados en él. Ya el calor recibido (QR) es la cantidad de calor que recibieron estos cubitos de hielo. Esta cantidad de calor tendrá dos naturalezas: calor sensitivo y caliente latente, ya que, para entrar en equilibrio térmico, es probable que los cubitos de hielo se derritan.
Determinación de la temperatura de equilibrio térmico
Determinemos la temperatura de equilibrio térmico a partir de la siguiente situación:
Una taza, con una capacidad térmica insignificante, que contiene 200 ml (200 g) de té a una temperatura inicial de 70 ° C, recibe 10 g de hielo a una temperatura de -10 ° C. Determine la temperatura de equilibrio térmico del sistema (suponga que el calor específico del té es igual al calor específico del agua):
Datos:
CAGUA = 1.0 cal / g ° C
CHIELO = 0,5 cal / g ° C
LHIELO = 80 cal / g
En primer lugar, consideramos que todo el calor que recibe el hielo lo regala el té:

A continuación, es necesario detallar qué formas de calor se dieron y recibieron:
Té: El té solo dio calor sensible (Qs), ya que su condición física no ha cambiado.
Hielo: El hielo estaba inicialmente a -10 ° C, por lo que recibió calor sensible (Qs) hasta una temperatura de 0 ºC, luego recibió calor latente (QL) licuar. Después de volverse líquido, recibió calor latente (Qs) hasta que entre en equilibrio térmico (TF) con té.
Traduciendo lo analizado anteriormente en forma de ecuación, tendremos el siguiente cálculo para resolver:
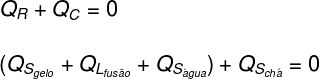
Reemplazando los datos proporcionados por el ejercicio en la ecuación que se encuentra arriba, tendremos que resolver el siguiente cálculo:
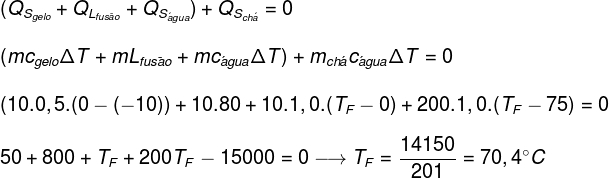
Según el cálculo realizado anteriormente, la temperatura de equilibrio del sistema té + hielo debe ser de aproximadamente 70,4 ° C.
Experimento de equilibrio térmico
Para probar el equilibrio térmico entre dos cuerpos, podemos realizar varios experimentos. El más simple de estos, sin embargo, implica el uso de un calorímetro es un termómetro. El calorímetro es un recipiente adiabático (que no permite el paso del calor), con capacidad térmica acerca dedespreciable, como una olla forrada con espuma de poliestireno, por ejemplo, que es un buen aislante térmico.

El calorímetro se utiliza para medir la variación de temperatura del sistema en el interior.
Equilibrio térmico y vida en la Tierra
O equilibriotérmico juega un papel fundamental en la vida terrestre. Sin la presencia de gases de efecto invernadero en la atmósfera terrestre, la mayoría de las Radiación termal del planeta lo dejaría, propagándose al espacio. Con el tiempo, esto provocaría un enfriamiento masivo en todo el planeta, lo que provocaría que los océanos se congelaran con el tiempo.
Además, los océanos juegan un papel clave en equilibriotérmico del planeta. En virtud de su gran pasta y calorespecífico, los océanos están dotados de una enorme capacidadtérmico, es decir, necesitan recibir enormes cantidades de calor para cambiar su temperatura. Por esta razón, son capaces de regular la temperatura del planeta de manera muy eficiente. Las regiones alejadas de los océanos y con poca agua suelen presentar grandes rangos térmicos, como en el caso de los desiertos, que son extremadamente calurosos durante el día y helados por la noche.
Por lo tanto, los equilibriotérmico es un proceso de fundamental importancia para el mantenimiento de los procesos físicos, químicos y biológicos del planeta y, por tanto, imprescindible para la existencia de vida en la Tierra.
Por mí. Rafael Helerbrock
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/equilibrio-termico.htm
