La polaridad de un enlace y una molécula está relacionada con la distribución de electrones alrededor de los átomos.Si esta distribución es simétrica, la molécula será no polar, pero si es asimétrica, y una de las partes de la molécula tiene mayor densidad de electrones, por lo que es una molécula polar.
La polaridad de las moléculas se puede visualizar cuando su sustancia constituyente se somete a un campo eléctrico externo. Si las moléculas se orientan en presencia de este campo, es decir, si una parte es atraída por el polo positivo y la otra parte de la molécula es atraída por el polo negativo, entonces, son polares. De lo contrario, si no se orientan, son apolares.
Por ejemplo, cuando frotas mucho una barra de vidrio con una franela, se carga positivamente. Si lo acercamos a un chorro de agua que cae de un grifo, veremos que el agua no seguirá cayendo en trayectoria vertical recta, sino que será atraída por el palo, sufriendo un desvío. Esto muestra que el agua es polar. Pero si hacemos este mismo experimento con un filete de aceite, no se desviará en su trayectoria, demostrando que sus moléculas son apolares.
Al analizar las estructuras de las moléculas, podemos determinar si son polares o no, teniendo en cuenta dos factores importantes: la diferencia de electronegatividad entre átomos y la geometría de la molécula.
1o) Electronegatividad entre átomos:
Si la molécula está formada por enlaces entre átomos de los mismos elementos químicos, es decir, si son sustancias simples como O2, H2, No2, Cℓ2, PAG4, S8, etc., serán no polares, porque no hay diferencia de electronegatividad entre sus átomos.
La única excepción es la molécula de ozono (O3), que se verá más adelante.
Si la molécula es diatómica y está formada por elementos de diferentes electronegatividades, entonces la molécula será polar. Ejemplos: HCℓ, HF, HBr y HI.
2o) Geometría de la molécula:
La geometría de la molécula afecta cómo se distribuirán los electrones en ella y, en consecuencia, su polaridad. Si la molécula está formada por tres átomos o más, tendremos que analizar cada enlace que se forma y la geometría de la molécula. Ver un ejemplo: CO2 - molécula lineal:
δ- δ+ δ-
O = C = O
Tenga en cuenta que el oxígeno es más electronegativo que el carbono, por lo que los electrones de enlace se sienten más atraídos por el oxígeno. En ellos se forma una carga negativa parcial (δ-), mientras que en el carbono se forma una carga parcial positiva (δ+). La multiplicación de la distancia entre los núcleos de los átomos enlazados con estas cargas en módulo (es decir, solo el número sin signo más o menos) se llama momento bipolar y está representado por μ.
μ = d. |δ|
Este momento dipolar está indicado por flechas que apuntan en la dirección del elemento más electronegativo, que atrae electrones: O ← C → O. Esto muestra que esta cantidad es un vector (una cantidad que tiene una magnitud o intensidad, dirección y dirección). Por lo tanto, está mejor representado por:  .
.

Sumando todos los vectores, encontramos el momento dipolar resultante, 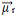 , que en este caso fue igual a cero porque los dos momentos dipolares tienen valores iguales, pero van en direcciones opuestas, anulándose entre sí.
, que en este caso fue igual a cero porque los dos momentos dipolares tienen valores iguales, pero van en direcciones opuestas, anulándose entre sí.
Cuando el vector de momento dipolar resultante es igual a cero, la molécula es no polar, pero si no es cero, será polar.
Por tanto, en el caso de la molécula de CO2, ella es apolar.
Ahora mira otro ejemplo: H2O - geometría angular (porque el oxígeno tiene dos pares de electrones disponibles en el nivel más externo, que repelen los electrones de los enlaces con hidrógenos):
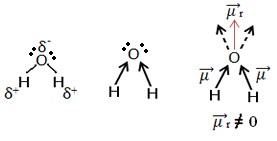
Los electrones se sienten atraídos por el oxígeno. Pero, en este caso, los vectores no se cancelan entre sí, porque la geometría molecular del agua es angular, ya que sus direcciones no son opuestos, dando un vector de momento dipolar resultante distinto de cero, y por lo tanto la molécula de agua es polar.
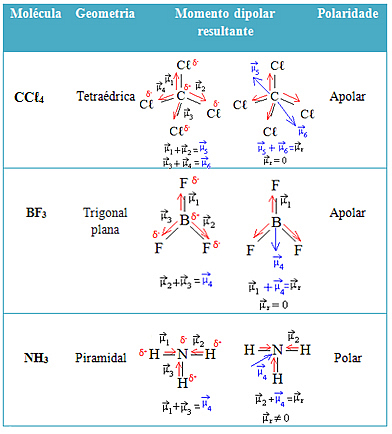
Vea más ejemplos en la siguiente tabla:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/polaridade-das-moleculas.htm
