En 1874, el químico holandés Jacobus Henrique van’t Hoff (1852-1911) y el químico francés Joseph Achille le Bel (1847-1930), a través de teorías matemáticas, sugirió independientemente la existencia de carbonos asimétrico.
En ese momento, fueron fuertemente criticados, sobre todo van't Hoff, por el famoso químico alemán Adolph Wilhelm Kolbe (1818-1884). Sin embargo, Kolbe estaba equivocado, hoy sabemos que hay un carbono asimétrico, tanto es así que, en 1901, van’t Hoff fue el primer químico en recibir el Premio Nobel.
van’t Hoff (izquierda) y Kolbe (derecha)
Una de las condiciones necesarias para que la molécula tenga actividad óptica es que sea asimétrica. Además, una forma de comprobar si es asimétrico es estudiar su estructura en detalle para ver si tiene al menos un carbono asimétrico.
¿Qué es una molécula asimétrica y un carbono asimétrico?
Algo simétrico es algo que tiene al menos un plano de simetría. Por ejemplo, si cortamos una raqueta de tenis por la mitad, las dos partes resultantes serán exactamente iguales. Además, si los colocamos frente a un espejo plano, producirán una imagen idéntica.
Las estructuras que no soportan un plano de simetría se denominan asimétrico. Un ejemplo es nuestra mano, porque si la colocamos frente a un espejo, producirá una imagen diferente de sí misma. Si colocamos la mano derecha, la imagen será la mano izquierda y viceversa. Otro punto importante es que no se superponen.
No pares ahora... Hay más después de la publicidad;)
Es por eso que el carbono asimétrico también se llama carbono quiral, de donde proviene esta palabra khéir que en griego significa mano.
Un ejemplo de molécula asimétrica es la talidomida, cuya estructura se muestra a continuación:

El punto situado con un asterisco (*) corresponde a un carbono asimétrico, ya que tiene cuatro enlaces covalentes que se forman con diferentes átomos o grupos de átomos.
A continuación se muestra un carbono con cuatro ligandos diferentes frente a un espejo. Tenga en cuenta que la imagen no se puede superponer sobre la estructura original:

Las dos moléculas obtenidas anteriormente son isómeros ópticos o enantiómeros.
Volviendo al caso de la talidomida, debido a que tiene carbono asimétrico, el resultado es que la molécula comienza a tener una imagen no superponible, que corresponde a otra sustancia. Entonces tenemos dos isómeros de talidomida con propiedades extremadamente diferentes.
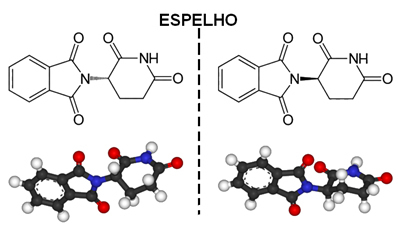
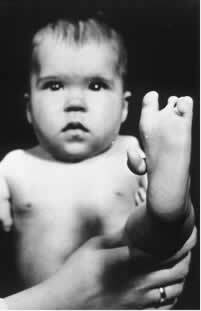
Uno de estos isómeros (R) tiene propiedades sedantes. Por lo tanto, a fines de la década de 1950, comenzó a usarse como tranquilizante y ayuda para dormir en mujeres embarazadas. Esto desencadenó una tragedia, ya que sus enantiómeros (S) también se mezclaron con la droga. Este isómero, a su vez, es teratogénico y ha llevado a muchas mujeres embarazadas a tener sus bebés con manos, piernas, brazos y pies atrofiados.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Carbón asimétrico o quiral"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/carbono-assimetrico-ou-quiral.htm. Consultado el 27 de junio de 2021.