* Teoría de Arrhenius:
Basado en sus experimentos con la conductividad eléctrica en medios acuosos, el químico, físico y matemático El sueco Svante August Arrhenius (1859-1927) propuso, en 1884, los siguientes conceptos para definir ácidos y bases:

Entonces, genéricamente, tenemos:
H+ + H2O → H3O+
Ejemplos:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NO3-
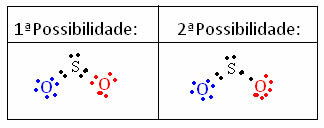
H2SOLO4+ 2H2O → 2H3O+ + SO42-

Ejemplos:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Teoría de Brönsted-Lowry:
Independientemente, el danés Johannes Nicolaus Brönsted (1879-1947) y el inglés Thomas Martin Lowry (1874-1936), propuso en el mismo año otra teoría ácido-base conocida como la teoría de Brönsted-Lowry, que dice que Siguiente:

En este caso, el ion hidrógeno se considera un protón. Esto se ve en la siguiente reacción, donde el ácido cianhídrico dona un protón al agua, que por lo tanto actúa como base:
HCN + H2O → CN- + H3O+
Esta reacción es reversible, con el ion hidronio (H3O+) puede donar un protón al ion CN-. Por tanto, el ion hidronio (H3O+) actúa como un ácido y el CN- como base.
CN- + H3O+→ HCN + H2O
* Teoría de Lewis:
Esta teoría fue creada por el químico estadounidense Gilbert Newton Lewis (1875-1946) y dice lo siguiente:

No pares ahora... Hay más después de la publicidad;)
Esta teoría introduce un nuevo concepto, es más completa, pero no invalida la teoría de Brönsted-Lowry. Porque cada ácido de Lewis es un ácido de Brönsted y, por lo tanto, cada base de Lewis es una base de Brönsted. Esto se debe a que un protón recibe electrones, lo que significa que un ácido de Lewis puede unirse a un par solitario de electrones en una base de Lewis.
Para Lewis, una reacción ácido-base consiste en la formación de un enlace covalente coordinado más estable. Entonces, cuando una base de Lewis dona un par de electrones a una base de Lewis, ambos forman una enlace covalente coordinado, en el que ambos electrones provienen de uno de los átomos, como en el ejemplo bramido:
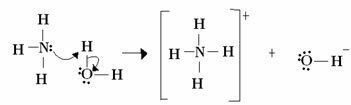
En este caso, el amoniaco actúa como base de Lewis y Brönsted, ya que dona sus dos electrones al protón y, por tanto, es el receptor del protón. Además, se formó un enlace covalente entre el hidrógeno (el protón) y el amoníaco.
El agua es ácido de Lewis y ácido de Brönsted, ya que dona el protón y recibe electrones, observe cómo el oxígeno en el hidróxido formado a partir del agua tiene un par adicional de electrones.

Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil.
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Teorías ácido-base de Arrhenius, Brönsted-Lowry y Lewis"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Consultado el 28 de junio de 2021.