Rieles son elementos que se caracterizan por su brillo, resistencia, conductividad térmica y eléctrica. Ellos son aplicable en prácticamente todos los procesos industriales, estando presente en aleaciones metálicas utilizadas en la fabricación de herramientas, joyas y monedas y en procesos químicos como el redox, responsable del funcionamiento de pilas y pilas.
En la tabla periódica, se clasifican en:
semimetales
metales de transición
Metales alcalinos
metales alcalinotérreos
En la industria del acero, se dividen en:
metales ferrosos
metales no ferrosos
metales pesados
Lea también: ¿Cuáles son los nuevos elementos de la tabla periódica?
Características de los metales

Son, en su mayor parte, excelentes conductores de calor y energía eléctrica.
Tienen una apariencia brillante.
tener alto densidad.
Son elementos electropositivos (tienden a formar cationes, cargas positivas).
Con la excepción del Mercurio, son elementos de alto punto de fusión y sólidos a temperatura ambiente.
Tienen resistencia mecánica (tenacidad).
Son maleables (se pueden moldear sin romperse).
No pares ahora... Hay más después de la publicidad;)
Metales de la tabla periódica
Metales alcalinos
Son los elementos de primera columna de la tabla periódica, familia 1A. Se les llama metales alcalinos porque, cuando se mezclan con agua, forman hidróxidos, es decir, una solución alcalina (básica).
Tú elementos que pertenecen a este grupo son:
Litio (li)
Sodio (A)
Potasio (K)
Rubidio (Rb)
Cesio (Cs)
Francio (Fr)
La configuración electrónica de los metales alcalinos en estado neutro (descargados / ionizados) solo presenta un electrón en la última capa (capa de valencia). O rayo atómico y la reactividad de estos metales aumenta de arriba a abajo (observando la Tabla periodica). Tienen un punto de fusión bajo en comparación con otros metales, son maleables y poco densos, tienen un aspecto mate debido a la alto potencial de oxidación.
Vea también:¿Cuáles son las propiedades de la materia?
metales alcalinotérreos
Estos son elementos que aparecen en el segunda columna de la tabla periódica, familia 2A. son llamados tierra alcalina por la tendencia a formar soluciones de carácter básico (alcalino), y por tierra porque, antes del siglo XIX, los óxidos formados por estas sustancias se designaban así. Este término se utilizó para designar metales no insolubles que no sufrieron mutación cuando se calentaron, características comunes de los elementos del grupo 2. Más tarde, a la luz de nuevas investigaciones y experimentos, se descubrió que los elementos "tierra" eran en realidad óxidos formados por metales.
Son metales maleables, de baja densidad, tienen dos electrones en su capa más externa, se encuentran, en condiciones normales de temperatura y presión, en estado sólido. Pertenecen a este grupo:
Berilio (Ser)
Magnesio (Mg)
Calcio (Aquí)
Estroncio (Mr)
Bario (Licenciado en Letras)
Radio (Rana)
metales de transición
componen el grupo B de la tabla periódica, y se encuentran entre los metales alcalinotérreos y el metales. Fueron definidos por la IUPAC como elementos que tienen una subcapa energética incompleta. El término "metales de transición" se refiere a transición del grupo 2 al 13 en la tabla periódica y la creciente adición de electrones en el orbital "d".
El grupo de los metales de transición está compuesto por elementos densos, con altos puntos de fusión y ebullición, y menos reactivo que los metales del grupo 1 y 2 (Familia 1A y 2A). Entre los metales de transición se encuentran el tungsteno, que es el elemento con mayor punto de fusión (3422 ° C), y el mercurio (Hg), que es un metal que es líquido en condiciones normales de temperatura y presión, su punto de fusión es (-38.83 ° C).
Los metales de transición tienen varios estados de oxidación (NOX variable) y forman sustancias coloreadas.

Elementos de transición internos
Elementos de transición internos ellos son:
Lantánidos: serie compuesta por elementos que tienen de 57 a 71 protones y que, a excepción del prometio, son naturales.
Actínidos: grupo formado por los elementos que van del 89 al 103 en número atómico y que, en su mayor parte, son sintéticos. Todo este grupo es radioactivo con vida media corta.
Los elementos de estos dos grupos tienen un alto punto de fusión y todos son sólidos a temperatura ambiente.
Semi metales
Tú semimetales hay, en total, siete elementos:
Boro (B)
Silicio (Si)
Germanio (Ge)
Arsénico (As)
Antimonio (Lun)
Telurio (Te)
Polonio (Po)
Esta clasificación se da a los elementos que tienen características fisicoquímicas relevantes para los metales y también otras relevantes para los elementos no metálicos. Los semimetales tienen brillo, son compuestos frágiles, capaces de formar cationes y también aniones (según la condición), y son conductores intermedios.
Tipos de metales
Ferroso: sustancias que contienen hierro en su composición. Ellos son aleaciones de metales que contienen hierro como elemento común, pero pueden formularse con diferentes concentraciones de carbón, por ejemplo, o forjados con diferentes técnicas, teniendo así productos con diferentes propiedades físicas.
No ferroso: aleaciones formadas por otros tipos de metales, como aluminio, cobre, níquel, zinc, titanio.
Metales pesados: plomo, níquel, zinc, mercurio. Son metales reactivos, tóxicos y bioacumulativos. Se utilizan en baterías, lámparas, municiones para artefactos de guerra, entre otros.
Enlaces químicos de metales
Los metales son elementos electropositivo, es decir, tienen tendencia a perder electrones en un enlace químico. Cuando un metal interactúa con otro no metálico, realiza un enlace iónico debido a la diferencia en electronegatividad. La otra posibilidad de unión para los metales son las uniones metálicas.
A conexiones de metal ocurren entre metales, con la liberación parcial de electrones y la formación de una nube o mar de electrones alrededor de los átomos, lo que garantiza a las partes metálicas las propiedades de conductividad eléctrica y maleabilidad.
Vea también: Conductores y aisladores: ¿cuáles son las diferencias?
Obtención de metales
La mayoría de los metales se encuentran naturalmente en rocas y minerales asociados con otros elementos. Existen varias técnicas para refinar metales, como mediante electrólisis y reacciones químicas para separar compuestos.
En el caso de los metales, las dos técnicas más utilizadas a escala industrial para obtener un cierto grado de pureza en un metal son: diferencia de densidad y susceptibilidad magnética (tendencia que tiene el metal a reaccionar ante un campo magnético).

Ejercicios resueltos
Pregunta 1 - (Enem) El cadmio, presente en las baterías, puede llegar al suelo cuando estos materiales se eliminan de forma irregular en el medio ambiente o cuando se incineran. A diferencia de la forma metálica, los iones Cd2 + son extremadamente peligrosos para el cuerpo, ya que pueden reemplazar Los iones Ca2 +, provocan una enfermedad degenerativa en los huesos, haciéndolos muy porosos y provocando fuertes dolores en los huesos. articulaciones. También pueden inhibir las enzimas activadas por el catión Zn2 +, que son extremadamente importantes para el funcionamiento de los riñones. La figura muestra la variación en el radio de algunos metales y sus respectivos cationes.
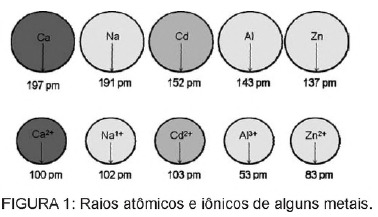
Según el texto, la toxicidad del cadmio en su forma iónica es una consecuencia de este elemento.
A) Presentan baja energía de ionización, lo que favorece la formación del ion y facilita su unión a otros compuestos.
B) tienen tendencia a actuar en procesos biológicos mediados por cationes metálicos con cargas que van desde +1 a +3.
C) tienen un radio y una carga relativamente cercanos a los iones metálicos que actúan sobre los procesos biológicos, provocando interferencias en estos procesos.
D) tienen un gran radio iónico, lo que le permite interferir en procesos biológicos en los que normalmente participan iones más pequeños.
E) tienen una carga +2, lo que le permite interferir con procesos biológicos en los que, normalmente, participan iones con cargas más bajas.
Resolución
Alternativa C. El cadmio es un elemento similar a los iones metálicos que tenemos naturalmente en el cuerpo. Además de ser bioacumulativo, el cadmio, al tener esta similitud con los grupos metálicos, puede unirse a grupos de moléculas sulfhidrilo. de proteínas, lo que provoca cambios en los procesos biológicos, como la descalcificación y la destrucción de tejidos y glóbulos rojos sangre.
Pregunta 2 - Para las características relevantes para los metales, marque la alternativa incorrecta.
A) La mayoría de los metales son buenos conductores eléctricos y térmicos.
B) Algunos metales son susceptibles de oxidación y / o reducción.
C) El hierro es un metal resistente y maleable, es decir, fácil de moldear.
D) Los metales alcalinotérreos tienen el nombre de “tierra” en referencia a los óxidos de estos metales, que son de color oscuro.
E) Los metales son elementos de colores variados y apagados, debido a la acción de oxidación.
Resolución
Alternativa E. Los metales son naturalmente brillantes y de color metálico, pueden sufrir oxidación, lo que provoca cambios en las características relevantes para el aspecto de la pieza, pero este no es un fenómeno que ocurre en todos los metales y, en algunos casos, la oxidación depende de varios factores externo.
por Laysa Bernardes
Profesor de química



