A fuerzas intermoleculares son un tema en Química que, seguro, puede aparecer en el Examen Nacional de Secundaria (Y también). Por lo tanto, vale la pena consultar los principales contenidos de esta asignatura en este artículo.
Definición
fuerzas intermoleculares son fuerzas - de diversa intensidad (débil, media o fuerte) - de atracción electrostática o enlaces que se establecen entre las moléculas de una sustancia que mantienen la unión entre ellas.
Tipos de fuerzas intermoleculares
La) Dipolo inducido
Y el Fuerza intermolecular que ocurre entre moléculas de una sustancia con una característica apolar. Ocurre, por ejemplo, entre moléculas de sustancias como O2, H2, No2, CO2, CH4.
La unión entre estas moléculas se produce cuando se crea un dipolo entre ellas. Esto sucede cuando los electrones de una molécula desplazan a los electrones de otra, creando así un polo negativo y uno positivo, que se transfiere de una molécula a otra.
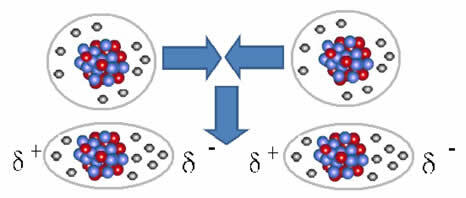
Representación de la formación de dipolos en moléculas apolares.
Entre estas moléculas, se formaron dos polos y el polo negativo de uno interactúa con el polo positivo del otro. Debido a que estos polos fueron creados, es una fuerza intermolecular de baja intensidad.
B) dipolo permanente
Y el Fuerza intermolecular que ocurre entre moléculas de una sustancia con una característica polar. Algunos ejemplos son moléculas de sustancias como HCN, H2O, NH3, CO, CH3Cl.
La unión entre estas moléculas ocurre cuando el polo negativo de una interactúa con el polo positivo de la otra.
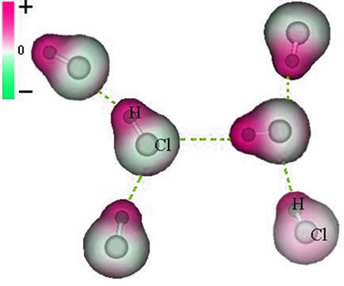
Representación de la fuerza dipolar permanente entre moléculas de HCl
Como los polos ya existen, la fuerza intermolecular del dipolo permanente es de mayor intensidad que el dipolo inducido.
C) enlaces de hidrógeno
Que Fuerza intermolecular ocurre entre moléculas polares que tienen un átomo de hidrógeno unido directamente a un átomo de oxígeno, nitrógeno o flúor.
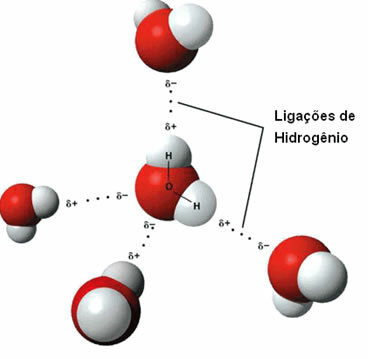
Representación de enlaces de hidrógeno entre moléculas de agua.
Un enlace de hidrógeno se forma cuando el hidrógeno de una molécula interactúa con el oxígeno, el nitrógeno o el flúor de la otra molécula.
d) ion dipolo
Esta fuerza intermolecular ocurre entre una molécula polar, que tiene un par de electrones no enlazantes, y un ion (catión o anión) en la solución.
La molécula de agua, por ejemplo, tiene dos pares de electrones que no se unen al oxígeno. Si hay iones en el medio acuoso, se acercan a la molécula de agua, ya que contiene polos.
No pares ahora... Hay más después de la publicidad;)
Importancia
La importancia de conocer el fuerzas intermoleculares para Enem es la comprensión que aportan sobre los estados físicos, el punto de fusión, el punto de ebullición y la solubilidad de las sustancias.
La) Relación con el punto de fusión y ebullición de la sustancia.
El punto de fusión indica la temperatura de transición de un estado sólido a un estado líquido, y el punto de ebullición indica la temperatura de la transición de un estado líquido a un gaseoso.
Este pasaje está directamente relacionado con la interacción entre las moléculas de la sustancia, ya que lo que diferencia un estado físico de otro es el nivel de agregación entre sus moléculas.
Por tanto, cuanto más intensa sea la fuerza intermolecular, mayores serán los puntos de fusión y ebullición. Cuanto menos intensa sea la fuerza intermolecular, menores serán los puntos de fusión y ebullición. Así, podemos definir el orden descendente de fusión y punto de ebullición:
Enlace de hidrógeno> dipolo permanente> dipolo inducido
B) Relación con la solubilidad
En general, debemos saber que lo semejante se disuelve como, es decir, la sustancia polar disuelve la sustancia polar y la sustancia apolar disuelve la sustancia apolar.
Sin embargo, todavía existe la posibilidad de interacción entre las moléculas de soluto y las moléculas de disolvente. Esto ocurre solo si esta nueva interacción es mayor que la que ya existe entre las moléculas de la sustancia misma.
Ejemplo de aplicación de fuerza intermolecular en Enem
1er Ejemplo: (Enem-2011) La piel humana, cuando está bien hidratada, adquiere buena elasticidad y un aspecto suave y terso. En cambio, cuando está seco, pierde su elasticidad y aparece opaco y rugoso. Para prevenir la sequedad de la piel, es necesario, siempre que sea posible, utilizar humectantes humectantes, generalmente hechos a base de glicerina y polietilenglicol:

La retención de agua en la superficie cutánea promovida por los humectantes es consecuencia de la interacción de los grupos hidroxilo de los agentes humectantes con la humedad contenida en el ambiente a través de:
a) enlaces iónicos
b) Fuerzas de Londres
c) enlaces covalentes
d) fuerzas dipolo-dipolo
e) enlaces de hidrógeno
La respuesta a esta pregunta es el enlace de hidrógeno, ya que la molécula de agua tiene un enlace de hidrógeno a un átomo de oxígeno. Lo mismo ocurre con las moléculas de propilenglicol y polietilenglicol, condición favorable para la ocurrencia de este tipo de fuerza intermolecular.
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "Fuerzas intermoleculares en Enem"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Consultado el 27 de junio de 2021.