Radioactividad es la propiedad de que algunos átomos, como uranio y radio, tiene que emitir espontáneamente energía en forma de partículas y onda, convirtiéndose elementos químicos más estable y más ligero.
Tipos
La radiactividad se presenta con dos caminos diferentes radiaciones: partícula - alfa (α) y beta (β); y onda electromagnética - rayos gamma (γ).
rayos alfa: son partículas positivas formadas por dos protones y dos neutrones y con bajo poder de penetración.
rayos beta: son partículas negativas que no contienen masa formada por un electrón (masa despreciable), y su poder de penetración es mayor que el de los rayos alfa, pero menor que el de los rayos gamma.
Gama: son ondas electromagnéticas de alta energía y, al no ser partículas, tampoco tienen masa.
Leer tambien: Fórmulas de radiactividad
No pares ahora... Hay más después de la publicidad;)
leyes
La emisión radiactiva de partículas sigue ciertos comportamientos que se explican por las leyes de radiactividad (una para la partícula alfa y otra para la partícula beta), que fueron descritas por el químico inglés
Frederick Soddyy por el químico y físico polaco Kazimierz Fajans.Primera ley de radiactividad
Según esta ley, cuando un átomo radiactivo emite radiación de tipo alfa, dará lugar a una nuevo átomo con núcleo que contiene dos protones y dos neutrones menos, totalizando una masa cuatro unidades más pequeñas. Podemos representar la primera ley de la radiactividad con la siguiente ecuación genérica:
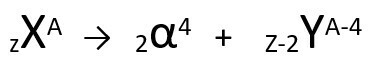
Ecuación genérica de la primera ley de radiactividad.
Veamos un ejemplo:
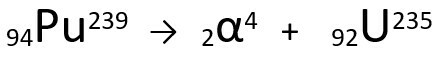
Ecuación que representa la emisión de partículas α por plutonio-239.
Tenga en cuenta que, al emitir una radiación alfa, el átomo recién formado, uranio-235, tiene un número de masa cuatro unidades más pequeño y el número atómico dos unidades más pequeño - exactamente los valores correspondientes a la partícula α emitida por el núcleo del plutonio. Para obtener más información, visite: Primera ley de radiactividad o primera ley de Soddy.
Segunda ley de radiactividad
La segunda ley habla de la problema beta. Cuando un átomo emite una partícula beta, que consta de un electrón y de masa insignificante, su masa atomica restos sin alterar es suyo el número atómico aumenta una unidad. Genéricamente, representamos lo siguiente:
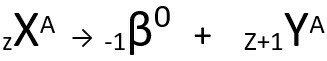
Ecuación genérica de la segunda ley de radiactividad.
Vea el ejemplo:
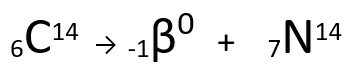
Ecuación que representa la emisión de partículas β por el Carbono-14.
Se puede observar que el átomo de nitrógeno formado tiene la misma masa que el átomo C-14, es decir, son isobaras, y su número atómico aumenta en una unidad. El aumento en número atómicofue explicado por el científico Henrico Fermi, quien propuso que uno de los neutrones del núcleo sufre una transmutación, de acuerdo con la siguiente ecuación, generando aelectrón(la partícula beta emitida), a neutrino(una partícula subatómica sin carga eléctrica y sin masa) y a protón(PAG).
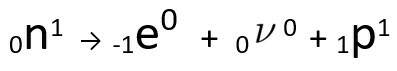
Ecuación que representa la transmutación de neutrones, según la hipótesis de Fermi.
O electrón es el neutrino se emiten a fuera del núcleo, restante solo el protón, que explica el aumento del número atómico Para obtener más información al respecto, vaya a: Segunda Ley de Radiactividad o Segunda Ley de Soddy.
Lea también: Diferencia entre contaminación radiactiva e irradiación
aplicaciones
a pesar de vista negativa que se deposita en radiactividad, tiene aplicaciones importantes en nuestra vida diaria, por ejemplo, en el produccion de energia electricaen plantas de energía nuclear mediante fisiónde átomos radiactivos.
Actualmente, Brasil no utiliza el energía nuclear como su principal fuente de energía, pero cuenta con plantas nucleares (Angra 1 y 2) trabajando para abastecer de electricidad al país. También podemos mencionar el material de citas encontrado por arqueólogos usando carbono-14.

Planta de energía nuclear de Río de Janeiro, Brasil
Otro papel fundamental que juega la radiactividad está relacionado con el área de la medicina, como en Rayos xy en el Tomografías computarizadas, y también en algunos tipos de tratamiento para el cáncer.
Leer tambien: Principales riesgos de la generación de energía nuclear para el medio ambiente
radiactividad natural
todos los días somos expuesto La pequeñas cantidades de radiación, ya sea artificial o natural. La radiactividad natural se produce de forma espontánea en la naturaleza. Parte de esta radiación que recibimos proviene de los alimentos que consumimos a diario, como el Radón-226 y el Potasio-40, que se presentan en niveles muy bajos y no ponen en riesgo nuestra salud ni dañan los valores nutricionales de los alimentos.
Este proceso de exposición de alimentos a emisiones radiactivas tiene como objetivo conservar la comida y promover una crecimiento de la planta. Algunos ejemplos de alimentos que emiten radiación son: Nuez de Brasil, plátano, frijoles, carnes rojas, entre otros.
Descubrimiento
El estudio de la radiactividad comenzó con una investigación del físico alemán Wilhelm Röentgen, en 1895, cuando estaba investigando el efecto deluminiscencia. Otro científico importante para el desarrollo de la radiactividad fue el físico francés Antoine-Henri Becquerel, quien notó, en 1896, las marcas hechas en una película fotográfica por una muestra de sal de uranio.
Sin embargo, fue el Pareja curie que utilizó el término radiactividad por primera vez. En 1898, el esmalte Marie Curie continuó los estudios sobre radiactividad y realizó valiosos descubrimientos para la zona, como el descubrimiento de dos nuevos elementos radiactivos: polonio (Po) y radio (Ra).
Posteriormente, Ernest Rutherford descubrió la radiación de tipo alfaα) y beta (β), lo que permitió mejores explicaciones de su modelo atómico, así como el avance de las investigaciones relacionadas con la radiactividad.
Lea también:Marie Curie: biografía, contribuciones y legado
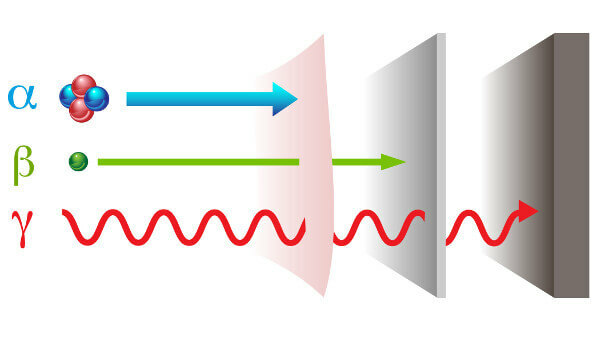
Tipos de radiación y sus poderes de penetración.
decaer
O desintegración radioactiva (o transmutación) es el proceso natural en cual núcleo inestable emite radiación, sucesivamente, a fin de baja tu energía y estabilizarse.
Esto ocurre normalmente con los átomos de número atómico. mayor que 84, que son átomos con alta inestabilidad nuclear debido a la cantidad de carga positiva (protones) acumulada en el núcleo. En este proceso, el los neutrones no son suficientes para estabilizar todos los protones agrupados en el núcleo, y luego el núcleo comienza a sufrir desintegración radiactiva hasta que su número atómico es inferior a 84.
En algunos casos, puede suceder que los átomos con un número atómico inferior a 84 tengan núcleos inestables y también pasan por el proceso de desintegración, pero para eso necesitan tener un número de protones muy por encima del número de neutrones.
La desintegración radiactiva es calculado por vida media (o período de semi-desintegración, P) del radioisótopo, que es el tiempo necesario para que la mitad de la masa de la muestra radiactiva inicial se desintegre, es decir, se estabilice. Hablando gráficamente, el concepto de vida media se representa a continuación. Porque es un proceso continuo, la curva tiende a alcanzar cero.
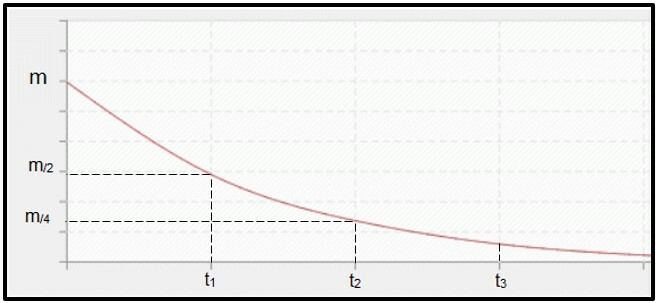
Gráfico que representa el tiempo de vida media.
Los cálculos relacionados con la desintegración radiactiva siguen las siguientes fórmulas:
Fórmula para calcular la masa restante después de la vida media:
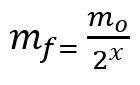
metroF - misa final
metroO - masa inicial
x - cantidad de vidas medias transcurridas
Fórmula para calcular el tiempo de desintegración de una muestra radiactiva:
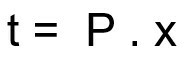
t - tiempo de desintegración
P - período de vida media
x - cantidad de vidas medias transcurridas
elementos radiactivos
Hay dos tipos de elementos radiactivos: usted natural y los artificial. Los naturales tienen elementos que se encuentran en la naturaleza, ya con sus núcleos inestables, como el uranio, O actinio es el radio. Los artificiales se producen mediante procesos que desestabilizan el núcleo de un átomo. En este caso, podemos mencionar el astato es el francio.
Los principales elementos radiactivos son: uranio-235, cobalto-60, estroncio-90, radio-224 y yodo-131. Debido a su amplio uso en centrales nucleares y tratamientos contra el cáncer, estos elementos suelen aparecer con mayor frecuencia en nuestra vida diaria. Para obtener más información sobre este tema, vaya a: elementos radiactivos.
Basura radiactiva
Residuos radiactivos o desperdicios nucleares es el residuo de El industrias que utilizan material radiactivo en sus procesos que ya no tienen aplicación práctica. Esta basura proviene principalmente de la plantas de energía nuclear es de Aplicaciones médicas.
La gran producción de residuos radiactivos ha sido un Problema ambiental para el mundo entero, debido a la escasez e inadecuada condiciones de eliminación y almacenaje.
Estos relaves están asociados con la contaminación del suelo, las vías fluviales y el aire, lo que resulta en destrucción del medio ambiente gradualmente. Además, también plantean riesgos para la salud humana, como infecciones, cáncer y, en casos más graves de contaminación, pueden conducir a muerte.
ejercicios resueltos
(PUC-Camp-SP) La bomba atómica, también llamada bomba nuclear, tiene átomos de uranio-235 como componente fisible, , emisores de partículas alfa
, emisores de partículas alfa  . Cada átomo de U-235, al emitir una partícula alfa, se transforma en otro elemento, cuyo número atómico es igual a
. Cada átomo de U-235, al emitir una partícula alfa, se transforma en otro elemento, cuyo número atómico es igual a
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Plantilla: Cuando un átomo emite una partícula alfa hay una disminución de dos unidades en el número atómico, de acuerdo con la primera ley de radiactividad. Por lo tanto: 92-2 = 90. Letra e.
(PUC-Camp-SP) El yodo-125, una variedad radiactiva de yodo con aplicaciones medicinales, tiene una vida media de 60 días. ¿Cuántos gramos de yodo-125 quedarán después de seis meses, basado en una muestra que contiene 2.00 g del radioisótopo?
a) 1,50
b) 0,75
c) 0,66
d) 0,25
e) 0,10
Plantilla: Primero, se calcula el número de vidas medias transcurridas durante los 180 días:
t = P. X
180 = 60. X
x = 3
Una vez que se encuentra el número de vidas medias transcurridas, se calcula la masa que quedará al final de los 180 días:
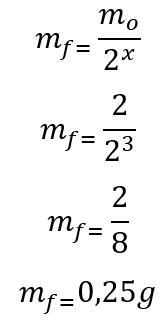
Por lo tanto, quedarán 0,25 g del radioisótopo de yodo-135 al final de los seis meses. Letra D.
Por Victor Felix
Licenciada en Química