El fenómeno de la radiactividad llamó la atención de numerosos científicos, incluido el físico neozelandés Ernest Rutherford (1871-1937). Realizó un experimento en el que un haz de partículas alfa (α) fue sometido a un campo eléctrico. Rutherford señaló al final del experimento que esta radiación estaría formada por partículas positivas, ya que fue atraída por el polo negativo.
También encontró que había partículas negativas que eran atraídas por el polo positivo; estas eran las partículas beta (β).Además, esta radiación tenía un mayor poder de penetración que la radiación alfa.
Sin embargo, hubo una de las emisiones radiactivas, la rango (γ), que no se sintió atraído por ninguno de los polos. Esto es incluso más enérgico que otras radiaciones. Por tanto, se concluyó que La radiación gamma (γ) no está formada por partículas, pero, como los rayos X, estaría formada por ondas electromagnéticas, además de no tener carga ni masa. Al no tener carga, esta radiación no sufre interferencias en el campo eléctrico.
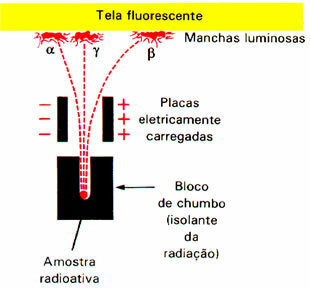
Un experimento realizado por Rutherford detectó que las partículas alfa y beta eran desviadas por el campo electromagnético.
Este y otros estudios posteriores demostraron que el modelo atómico de Dalton, en el que el átomo sería una esfera, masiva e indivisible, no podía ser correcto; porque, como se vio arriba, el átomo debe tener partículas más pequeñas con cargas positivas y negativas.
En 1911, Rutherford propuso que el átomo estaría compuesto por un núcleo atómico, en el que estarían las partículas positivas, llamadas protones; y en la electrosfera, es decir, en la región alrededor del núcleo, las partículas negativas (electrones) estarían girando en órbitas circulares.
No pares ahora... Hay más después de la publicidad;)
Él mismo descubrió más tarde que la radiactividad era un fenómeno que se producía en núcleos atómicos inestables.
Los físicos F. Soddy, A. Russell y K. Los fajans, independientemente unos de otros, descubrieron cuáles eran las partes correspondientes de estas radiaciones dentro del átomo:
* Partículas alfa (α):Cuando emite una partícula alfa, el átomo del elemento radiactivo en realidad está emitiendo dos protones y dos neutrones (la carga positiva se debe a los protones);

Cuando un elemento emite una partícula alfa, está emitiendo dos protones y dos neutrones.
*Partículas beta (β): Cuando un elemento radiactivo emite una partícula beta, está perdiendo un electrón y una subpartícula llamada antineutrino. Un neutrón se descompone dando lugar a un protón que permanece en el núcleo, un electrón y un antineutrino que se emiten.
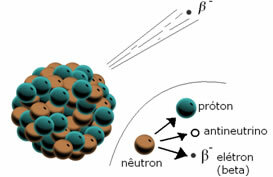
Cuando un elemento emite una partícula beta, está emitiendo un electrón.
Así, la caracterización de estos tres tipos de radiación se da a continuación:
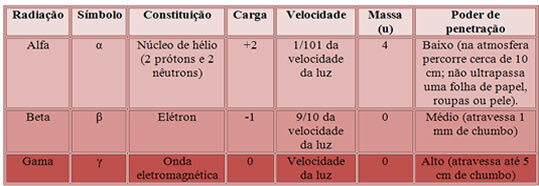
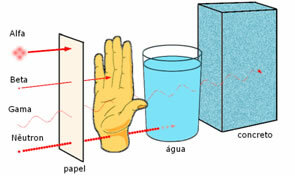
Poder de penetración de las tres principales radiaciones nucleares.
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil.
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Radiactividad y estructura del átomo"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/radioatividade-estrutura-atomo.htm. Consultado el 27 de junio de 2021.



