Como se muestra en los textos "Espectro electromagnético de elementos químicos." y "Espectros de emisión y absorción y leyes de Kirchhoff”, Los espectros de emisión discontinua de cada elemento químico son diferentes.

Entonces, a continuación tenemos los distintos espectros de algunos de estos elementos:

Así, el físico danés Niels Böhr (1885-1962) se dio cuenta de que esto podría estar relacionado con la estructura del átomo de cada uno de estos elementos. Así que propuso un modelo atómico que complementaba el modelo de Rutherford, pero se centró en el comportamiento de los electrones circundantes en el núcleo del átomo.
Algún tiempo antes, Max Planck (1858-1947) había propuesto una teoría de que los electrones son cuantificado, en el sentido de que emiten y absorben cantidades específicas de energía, como si fueran pequeños paquetes de energía, al que llamó cuánto (cuántico, en singular).
Por tanto, Böhr propuso lo siguiente: dado que cada elemento tiene un espectro diferente, cada elemento tiene en su átomo electrones de energías constantes y diferentes de un elemento a otro.
Cada electrón solo puede permanecer en una determinada órbita, porque en cada una de estas órbitas el electrón tiene una energía constante, bien definida y característica. El electrón solo puede ocupar los niveles de energía para los que tiene la energía respectiva.
Los espectros son discontinuos porque los electrones están cuantificados.
Un electrón solo puede cambiar de nivel si absorbe energía. Por ejemplo, cuando quema una sal de sodio en un mechero Bunsen, está suministrando energía a los electrones. Al absorber un cuanto de energía, el electrón salta a otro nivel más energético, permaneciendo en el estado excitado. Sin embargo, el estado fundamental es más estable, por lo que este electrón emite la energía absorbida y vuelve a su órbita original. Emite esta energía en forma de ondas electromagnéticas que se pueden visualizar en forma de luz. En el caso del sodio, esta luz es de color amarillo intenso. Así, cuando estas ondas atraviesan un prisma, se obtiene el espectro discontinuo de sodio.
Entonces, para Böhr, cada línea luminosa que aparecía en el espectro discontinuo de los elementos indicaba la energía liberada cuando el electrón regresaba de un nivel externo a uno más cercano al núcleo.
La siguiente figura ayuda a comprender mejor este problema:
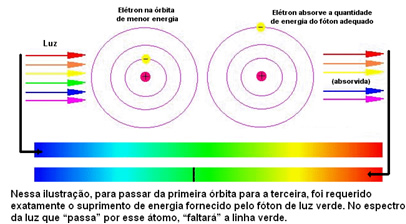
Como a los átomos de cada elemento solo se les permiten ciertos valores de energía que corresponden a las capas de energía, para cada elemento hay un espectro diferente.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
