Los átomos son partículas infinitamente pequeñas que componen toda la materia del universo. Con el tiempo, la idea de cómo sería la estructura atómica cambió según los nuevos descubrimientos realizados por los científicos. Puede encontrar más información sobre esto en el texto.Evolución del modelo atómico.
Un modelo es una representación de la realidad (no la realidad en sí), por lo que los modelos atómicos son representaciones de componentes principales del átomo y su estructura y explican cierto comportamiento físico y químico de la materia. Esto se hace porque todavía no es posible que un ser humano vea un átomo aislado incluso con ultramicroscopios.
Para tener una idea de lo pequeño que es el átomo, sepa que La ¡La partícula más pequeña visible bajo un microscopio ordinario contiene más de diez mil millones de átomos! El átomo es tan pequeño que, si ponemos un millón de ellos uno al lado del otro, no alcanzaríamos el espesor de un cabello.
Mapa mental: átomo
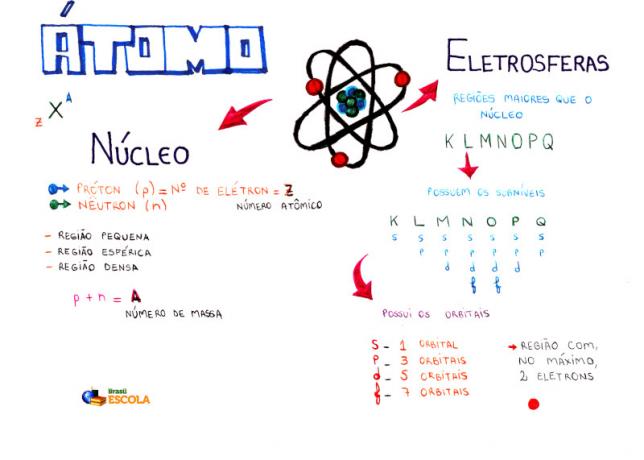
* Para descargar el mapa mental en PDF, Haga clic aquí!
Entre los modelos atómicos, el más utilizado actualmente en el bachillerato para comprender la estructura del átomo y sus propiedades es el modelo de Rutherford-Bohr. Según este modelo, la estructura del átomo consta de dos partes principales: la centro y el electrosfera.

Dos partes principales de la estructura de un átomo: electrosfera y núcleo.
* Centro: Constituyendo la parte central del átomo, es compacto, masivo y muy denso, además de estar formado por partículas de mayor masa, que son protones y neutrones.

Ilustración de los protones y neutrones que componen el núcleo atómico
- Protones: son partículas con carga eléctrica positiva (carga relativa = +1; carga en culombio (C) = +1.602. 10-19) y su masa relativa es igual a 1.
El hecho de que los protones forman el núcleo y le dan una carga positiva general fue descubierto por Eugen Goldstein, en 1886, mediante una modificación en la ampolla de Crookes y algunos experimentos. Vio que, bajo voltajes muy altos, aparecían emisiones (rayos anódicos, remanentes de átomos del gas que estaban dentro del bulbo y cuyos electrones fueron arrancados por la descarga eléctrica). Al colocar un campo eléctrico o magnético fuera de la bombilla, estos rayos se desvían hacia el polo negativo. Esto significaba que había partículas subatómicas positivas, que se llamaban protones.
Más tarde, Ernest Rutherford (1871-1937) realizó el experimento descrito en el texto Átomo de Rutherford, lo que le llevó a descubrir la ubicación del protón: en el núcleo.
- Neutrones: son partículas con una masa igual a la de los protones (1), pero como su nombre lo indica, son neutras, es decir, no tienen carga eléctrica.
Los neutrones fueron descubiertos en 1932 por James Chadwick (1891-1974), quien se dio cuenta de que el núcleo de berilio radiactivo emitía partículas neutras con una masa aproximadamente igual a la masa de los protones (en realidad, es un poco más grande).
No pares ahora... Hay más después de la publicidad;)
El diámetro del núcleo depende de la cantidad de protones y neutrones que tenga el átomo, pero, en promedio, ronda los 10-14 mes y 10-15 metro.
El núcleo atómico concentra prácticamente toda la masa del átomo, siendo una parte muy pequeña: ¡tanto el protón como el neutrón son unas 100.000 veces más pequeños que todo el átomo! A modo de comparación, imaginemos que agrandamos el núcleo del átomo del elemento hidrógeno (que solo tiene un protón) al tamaño de una pelota de tenis, el electrón más cercano estaría a unos tres kilómetros de ¡distancia! Incluso si un átomo se agrandara a la altura de un edificio de 14 pisos, su núcleo sería del tamaño de un simple grano de sal en el séptimo piso. Es realmente algo asombroso, ¿no crees?
* Electrosfera: Es una región donde los electrones giran alrededor del núcleo. A pesar de ser una región de mucho mayor volumen que el núcleo, está prácticamente vacía, ya que cada electrón es 1836 veces más pequeño que 1 protón (o que 1 neutrón). Es por eso que la masa del átomo está prácticamente toda en el núcleo. Los electrones son partículas con carga eléctrica negativa (-1).
Los electrones fueron descubiertos en 1897 por Joseph John Thomson (1856-1940), creador de Modelo atómico de Thomson. El experimento de Thomson se puede ver en detalle en el texto. El experimento de Thomson con descargas eléctricas, pero en resumen, utilizó la ampolla de Crookes antes mencionada y se dio cuenta de que los rayos catódicos siempre estaban atraído por el polo positivo, lo que demostró que el átomo tenía partículas negativas, que fueron llamadas electrones.
Los electrones giran alrededor del núcleo miles de millones de veces por millonésima de segundo, dando forma al átomo y haciéndolo comportarse como si fuera sólido.
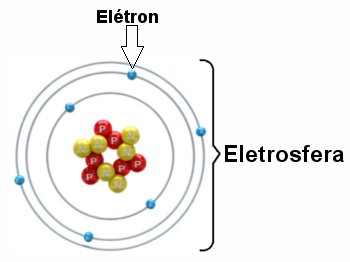
Ilustración de una electrosfera con tres capas electrónicas y electrones que giran alrededor del núcleo.
Brevemente, podemos hacer una tabla para diferenciar las tres principales partículas subatómicas que forman parte de la estructura del átomo:

Masa y carga eléctrica de las tres partículas subatómicas principales: protones, neutrones y electrones.
Los átomos de todos los elementos químicos están compuestos por estas tres partículas subatómicas. Lo que diferencia a un elemento químico de otro es la cantidad en la que aparecen estas partículas, especialmente la cantidad de protones en el núcleo, que se llama número atómico. Sigue estudiándolo a través del texto. Elemento químico.
* Mapa mental de mí. Diogo Lopes
Por Jennifer Fogaça
Licenciada en Química
Química
Clasificación de materia, agua, gas cianhídrico, dióxido de carbono, amoníaco, hidrógeno, helio, sustancias sustancias simples, compuestas, mezclas, fases de una mezcla, mezcla homogénea, mezcla heterogéneo.