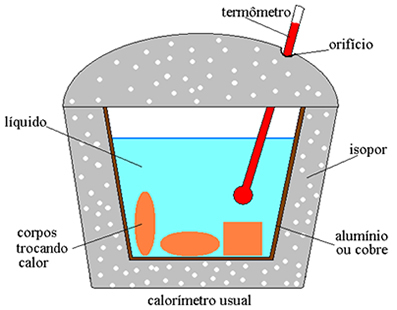
Energíatérmico es un término amplio, utilizado para expresar diferentes cantidades termodinámicas, como energía interna o una cantidad de calor intercambiado entre sistemas de muchas diferentestemperaturas. En este artículo trataremos la energía térmica como sinónimo de energíainterno, que puede entenderse como la suma de los energíascinética y potencial De átomos y moléculas que componen un sistema termodinámico.
veaademás:Antes de continuar, consulte un resumen asombroso sobre termología.
Energía térmica
Energíatérmico es el resultado de suma da energíacinética y potencial de todas las partículas constituyentes de un cuerpo. energía térmica Dependedirectamente da temperaturaabsoluto del cuerpo, medido en kelvin (K), y también depende de la cantidad de gradosenlibertad del sistema, es decir: el número de direcciones en las que las moléculas pueden moverse, vibrar, oscilar o incluso girar.

O teoremadaequipartición de energía establece que: en cada grado de libertad de un sistema, su energía interna se puede calcular a partir de un múltiplo entero de la expresión ½ kBT, donde Kb es el constanteenBoltzmann y T es el temperatura medido en kelvin. La fórmula utilizada para calcular la energía térmica de un gas monoatómico ideal se muestra a continuación, compruébalo:
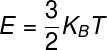
KB - Constante de Boltzmann (KB = 1,38.10-23 m².kg / s². K)
Dado que la energía térmica de los gases ideales se expresa mediante la fórmula anterior y representa la energíacinéticapromedio del sistema, podemos escribir la siguiente igualdad:
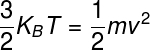
veaademás:Después de todo, ¿de qué color es el agua?
Usando la fórmula anterior, es posible estimarla velocidad de traslación promedio de los átomos presentes en el gas atmosférico. Teniendo en cuenta una temperatura de 25 ° C y tomando átomos de oxígeno (M = 16 g / mol), encontramos una velocidad promedio de 680 m / so 1525 km / h; esta es la velocidad a la que las partículas de gas atmosférico nos golpean todo el tiempo.
No pares ahora... Hay más después de la publicidad;)
En el caso de un gas diatómico, el factor ½k se suma a la expresión utilizada para los gases monoatómicos.BT, debido al aumento de un grado de libertad, resultando en la siguiente expresión:

De acuerdo con primera ley de termodinámica, a energíatérmico de un sistema se puede convertir en otras formas de energía, como calor y trabaja. El calor, por ejemplo, se refiere a la transferirenenergíatérmico,exclusivamente debido a la diferencia de temperatura entre un sistema y su entorno; el trabajo, a su vez, se refiere a la aplicación de fuerzas sobre el sistema o por el sistema.
En este sentido, el trabajo se puede utilizar para mover un pistón, como en las locomotoras de vapor, y también en motores de combustión interna, que alimentan prácticamente a todos los vehículos de motor actuales. A continuación, traemos la primera ley de la termodinámica, nota:
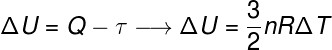
Según la 1ª ley de la termodinámica, la variación de la energía interna es la diferencia entre trabajo y calor.
Hay otras formas de calcular el módulo de energía térmica de un cuerpo, en el caso de gasesideales, en el que la energía potencial entre partículas se considera nula, para ello expresamos la energía interna en términos del número de lunares (n) y también de la constante universal de gases perfectos (R), verifique:
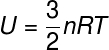
n - número de moles (mol)
R - constante universal de gases perfectos (R = 0.082 atm. L / mol. K o 8,31 J / mol. K)
Aún dentro del alcance de los gases perfectos, combinando el ecuación de clapeyron (PV = nRT), con la definición de energía expuesta, es posible obtener una nueva expresión, tenga en cuenta:

PAG - presión (Pa)
V - volumen (m³)
Vea también:El aire caliente sube y el aire frío desciende, pero ¿por qué?
Ventajas y desventajas de la energía térmica
Todos los días utilizamos una gran cantidad de fuentesenenergíatérmico para producir energía. O cuerpo humano, por ejemplo, consume una gran cantidad de nutrientes generar la energía térmica necesaria para el funcionamiento de nuestros procesos vitales. mucho de energia electrica producido en el mundo depende de nuestra capacidad para transformar la energía térmica en electricidad.
Consulta los medios que utilizan la energía térmica para producir electricidad y sus principales ventajas y desventajas:
tipo de planta |
Beneficios |
Desventajas |
planta termonuclear |
Baja emisión de gases contaminantes y alta eficiencia. |
Producción de desechos radiactivos y exposición a la radiación |
Central termoeléctrica de carbón |
Gran producción de energía y bajo costo. |
Emisión de gases contaminantes y de efecto invernadero |
Central termoeléctrica alimentada por gas natural |
Menos contaminación que la quema de carbón |
Su costo varía mucho, ya que el gas natural es un derivado del petróleo. |
Planta termoeléctrica de biomasa |
Bajo costo de instalación y bajas emisiones de gases de efecto invernadero. |
Deforestación y grandes plantaciones de monocultivos |
planta geotermica |
No contamina |
Alto costo de instalación y mantenimiento |
Vea también: ¡Aprenda hidrostática de una vez por todas!
Ejercicios sobre energía térmica
Pregunta 1) Dos moles de un gas diatómico ideal se encuentran a una temperatura de 127 ° C. La energía térmica de este gas es aproximadamente:
Datos: R = 8,31 J / mol. K
a) 1.5.106 J
b) 1.7.104 J
c) 8.5.103 J
d) 5.3.104 J
e) 8.5.104 J
Plantilla: Letra b
Resolución:
Calculemos la energía del gas usando la siguiente expresión, ya que el gas es diatómico, sin embargo, antes de hacerlo, es necesario convertir la temperatura de grados centígrados a kelvin, tenga en cuenta el cálculo:
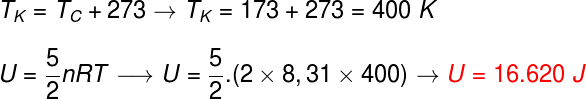
Según cálculos, este gas diatómico tiene una energía de 16.620 J, es decir, aproximadamente 1,7.104 J, si se expresa en notación científica y utilizando las reglas de redondeo.
Pregunta 2) Tres moles de un gas monoatómico ideal reciben una cantidad de calor igual a 5.102 cal y realiza un trabajo de 2.102 cal durante el proceso. Determine la variación de temperatura que experimenta este gas, en grados Celsius.
Datos: R = 0,082 atm. L / mol. K
a) 214 ° C
b) 813 ° C
c) 1620 ° C
d) 740 ° C
e) 370 ° C
Plantilla: Letra b
Resolución:
Para resolver este ejercicio, es necesario que combinemos dos fórmulas distintas, la primera ley de termodinámica, que determina la variación de energía, y la fórmula de la energía térmica del gas monoatómico ideal, mirar:
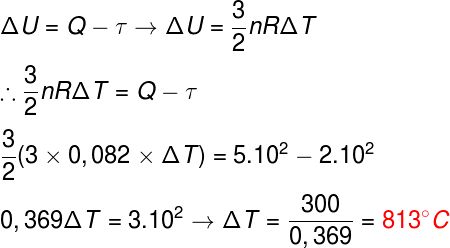
Después de haber reemplazado los datos en las fórmulas, encontramos una variación de 813 ° C, por lo que la alternativa correcta es la letra B.
Por mí. Rafael Helerbrock