Το κείμενο Αντιδράσεις προσθήκης έδειξε ότι αυτοί οι τύποι οργανικών αντιδράσεων ονομάζονται με αυτόν τον τρόπο επειδή ένα αντιδραστήριο προστίθεται στο οργανικό μόριο με τη διάσπαση δεσμών μεταξύ άνθρακα. Σε αυτό το κείμενο παρουσιάστηκε η περίπτωση των αλκενίων, εδώ θα εξετάσουμε ήδη πώς συμβαίνει αυτό με αλκύνια, ή δηλαδή, με εκείνους τους υδρογονάνθρακες (που σχηματίζονται μόνο από άτομα άνθρακα και υδρογόνου) που έχουν δεσμό τριπλούς.
Το ευάλωτο σημείο των αλκυνών είναι ακριβώς ο τριπλός δεσμός, όπου οι δεσμοί τύπου pi (π) μπορούν να σπάσουν ένα (προσθήκη μερική) ή δύο φορές (ολική προσθήκη) και δημιουργούν αντίστοιχα νέες ενώσεις με διπλούς (αλκένια) ή μεμονωμένους δεσμούς (αλκάνια).
Ας δούμε τις περιπτώσεις αντιδράσεων προσθήκης σε αλκύνια:
1. Προσθήκη υδρογόνου ή υδρογόνωσης:
Στην περίπτωση αυτή, το μόριο Η2 προστίθεται στο αλκύνιο χρησιμοποιώντας έναν καταλύτη, ο οποίος είναι συνήθως κονιοποιημένο νικέλιο (Ni), λευκόχρυσο (Pt) ή παλλάδιο (Pd). Λόγω της ανάγκης χρήσης καταλύτη, αυτή η αντίδραση ονομάζεται επίσης
καταλυτική υδρογόνωση και συμβαίνει σταδιακά: στο πρώτο στάδιο παίρνετε αλκένιο και στο δεύτερο στάδιο, το οποίο είναι πιο αργό, παίρνετε ένα αλκάνιο.Εάν ο χρησιμοποιούμενος καταλύτης είναι ισχυρός, όπως νικέλιο και πλατίνα, η αντίδραση παράγει άμεσα αλκάνιο. Το παλλάδιο αναμιγνύεται με BaSO4 Είναι ένας ασθενής καταλύτης και παράγει αλκένιο. Είναι επίσης δυνατό να χρησιμοποιηθεί ένας μερικός αναστολέας καταλύτη για να φτάσει μόνο το αλκένιο. Αυτή η αντίδραση λαμβάνει χώρα επίσης υπό υψηλές πιέσεις και θερμοκρασίες.
Στη συνέχεια, έχουμε την προσθήκη υδρογόνου στο αιθάνιο, παράγοντας αιθυλένιο και στη συνέχεια αιθάνιο:

2. Προσθήκη αλογόνων ή αλογόνωσης:
Ένας δεσμός pi του αλκυνίου είναι σπασμένος και δύο άτομα αλογόνου προστίθενται στο μόριο (στοιχεία από την οικογένεια 17Α του Περιοδικού Πίνακα, το πιο χρησιμοποιούμενο είναι: Cl2 και Br2σχηματίζοντας ένα γειτονικό διαλίδιο, που σημαίνει ότι δύο άτομα αλογόνου συνδέονται με γειτονικά άτομα άνθρακα. Η αντίδραση μπορεί να συνεχιστεί, σπάζοντας τον άλλο δεσμό pi και προσθέτοντας δύο ακόμη άτομα αλογόνου στο μόριο.
Στο παρακάτω παράδειγμα, έχουμε αυτόν τον τύπο προσθήκης στη δωροδοκία:
ΚλCl ClΚλ
││ ││
Η ─C ≡ Γ CH3 + Κλ2 → Η ─ Γ ═ Γ CH3 + Κλ2 → Η ─ Γ ─ Γ CH3
││
ΚλΚλ
ALCINO DI-HALETTE TETRAHALETTE
3. Προσθήκη αλογονιδίων υδρογόνου (αλογονυδρίτες ή υδροαλογονώσεις):
Εδώ, ένα αλογονίδιο υδρογόνου προστίθεται στο αλκύνιο, και μπορεί επίσης να πραγματοποιηθεί μερική και ολική προσθήκη. Μια σημαντική πτυχή αυτού του τύπου αντίδρασης είναι ότι ακολουθεί το Ο κανόνας του Μάρκοβνικοφ, δηλαδή, το υδρογόνο συνδέεται με τον περισσότερο υδρογονωμένο άνθρακα (με περισσότερα άτομα υδρογόνου συνδεδεμένα) και το αλογόνο συνδέεται με τον λιγότερο υδρογονωμένο άνθρακα.
Σε ολική υδροαλογόνωση, σχηματίζεται ένα δαλίδιο του γεμικού, δηλαδή μια ένωση που έχει δύο άτομα αλογόνου συνδεδεμένα στον ίδιο άνθρακα.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Παρακολουθώ:
ΗBr Ηαδερ
││ ││
Η ─C ≡ Γ CH3 + HBr → Η ─ Γ ═ Γ CH3 + HBr → Η ─ Γ ─ Γ CH3
││
Ηαδερ
ALCINO HALIDE GEMIC DI-HALOGIDE
Ένα σημαντικό παράδειγμα αυτού του τύπου αντίδρασης είναι αυτό που εμφανίζεται όταν προστίθεται υδροχλώριο στην αιθίνη, σχηματίζοντας το χλωροαιθένιο ή μονοχλωριούχο βινύλιο, που είναι το μονομερές που σχηματίζει το πολυμερές πολυβινυλοχλωριδίου, περισσότερο γνωστό με το ακρωνύμιο του PVC.
ΗClHΚλ
││ ││
Η ─C ≡ C ─ Η + ΗΟΙ → Η ─ Γ ═ C ─ Η + ΗΟΙ → Η ─ Γ ─ Γ-Η
││
ΗΚλ
ETHINO CHLOROETENE 1,1-DICHLOROETHANE
(Μονομερές PVC)
Το PVC είναι μια ουσία που χρησιμοποιείται ευρέως στη βιομηχανία για την κατασκευή διαφόρων προϊόντων, όπως σανδάλια, φιάλες φαρμάκων, ιατρικές συσκευές, πλαστικά παντελόνια για μωρά, τσάντες, επιστρώσεις καλωδίων, παιχνίδια, ταπετσαρίες επίπλων, ταπετσαρίες αυτοκινήτων, αδιάβροχα, πλαστικά παπούτσια, δίσκους βινυλίου, δάπεδα, μεμβράνες συσκευασίας, σωλήνες που χρησιμοποιούνται σε σωλήνες νερού και λύματα κ.λπ.
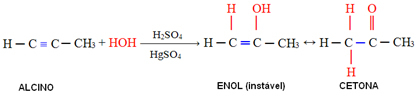
4. Προσθήκη νερού (ενυδάτωση):
Σε αυτήν την αντίδραση, το νερό αντιδρά με αλκύνιο, σχηματίζοντας αρχικά ένα ενολικό, το οποίο υφίσταται μοριακή αναδιάταξη και μετατρέπεται σε αλδεΰδη (στην περίπτωση αλκυνών μικρότερη από το ακετυλένιο). Η ενόλη και η αλδεΰδη παραμένουν σε δυναμική ισορροπία με την υπεροχή της αλδεΰδης. Αυτή είναι μια περίπτωση Δυναμική Constitucikonal Isomery ή Tautomery.
Παράδειγμα:

Στην περίπτωση αλκυνών μεγαλύτερων από το ακετυλένιο, ακολουθείται ο κανόνας Markovnikov και το enol δημιουργεί κετόνη:
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία